- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Новые рекомендации Американского колледжа гастроэнтерологии (ACG) по кровотечениям из верхних отделов желудочно-кишечного тракта и из язвенных кровотечений 2021
| Авторы: | Loren Laine, MD, FACG1,2, Alan N. Barkun, MD, FACG3, John R. Saltzman, MD, FACG4, Myriam Martel, MSc2 and Grigorios I. Leontiadis, MD, PhD5 2021г. |
Аннотация:
Мы провели систематические обзоры, посвященные заранее определенным клиническим вопросам, чтобы разработать рекомендации с использованием подхода GRADE в отношении ведения пациентов с явным кровотечением из верхних отделов желудочно-кишечного тракта. Мы предлагаем оценку риска в отделении неотложной помощи для выявления пациентов с очень низким риском (например, оценка Глазго-Блатчфорда = 0–1), которые могут быть выписаны с амбулаторным наблюдением. Пациентам, госпитализированным с кровотечением из верхних отделов желудочно-кишечного тракта, мы предлагаем переливание эритроцитов с порогом 7 г / дл. Инфузия эритромицина рекомендуется перед эндоскопией, а эндоскопия - в течение 24 часов после постановки диагноза. Эндоскопическая терапия рекомендуется при язвах с активным излитием или просачиванием, а также при отсутствии кровотечения из видимых сосудов. Рекомендуется эндоскопическая терапия с биполярной электрокоагуляцией, нагревательным датчиком и инъекцией абсолютного этанола. доказательства низкого или очень низкого качества также поддерживают клипсы, коагуляцию аргоноплазмой и мягкую монополярную электрокоагуляцию; Гемостатический порошковый спрей TC-325 рекомендуется при активно кровоточащих язвах и зажимных приспособлениях для повторного кровотечения из язвы после предыдущего успешного гемостаза. После эндоскопического гемостаза рекомендуется терапия высокими дозами ингибитора протонной помпы непрерывно или с перерывами в течение 3 дней с последующим приемом перорального ингибитора протонной помпы два раза в день в течение первых 2 недель терапии после эндоскопии. При рецидивирующем кровотечении рекомендуется повторная эндоскопия, а в случае неудачной эндоскопической терапии - транскатетерная эмболизация. Гемостатический порошковый спрей TC-325 рекомендуется при активно кровоточащих язвах и зажимах, выходящих за пределы области применения, при повторном кровотечении из язвы после предыдущего успешного гемостаза. После эндоскопического гемостаза рекомендуется терапия высокими дозами ингибитора протонной помпы непрерывно или с перерывами в течение 3 дней с последующим приемом перорального ингибитора протонной помпы два раза в день в течение первых 2 недель терапии после эндоскопии. При рецидивирующем кровотечении рекомендуется повторная эндоскопия, а в случае неудачной эндоскопической терапии - транскатетерная эмболизация. Гемостатический порошковый спрей TC-325 рекомендуется при активно кровоточащих язвах и зажимах, выходящих за пределы области применения, при повторном кровотечении из язвы после предыдущего успешного гемостаза. После эндоскопического гемостаза рекомендуется терапия высокими дозами ингибитора протонной помпы непрерывно или с перерывами в течение 3 дней с последующим приемом перорального ингибитора протонной помпы два раза в день в течение первых 2 недель терапии после эндоскопии. При рецидивирующем кровотечении рекомендуется повторная эндоскопия, а в случае неудачной эндоскопической терапии - транскатетерная эмболизация.

Полный текст статьи:
ВСТУПЛЕНИЕ
Желудочно-кишечное кровотечение (ЖКТ) является наиболее распространенным диагнозом ЖКТ, требующим госпитализации в США, на которое ежегодно приходится более полумиллиона госпитализаций ( 1,2 ). Кровотечение из верхних отделов ЖКТ (UGIB) относится к кровотечениям, исходящим из участков пищевода, желудка или двенадцатиперстной кишки. Около 80% пациентов, посещающих отделения неотложной помощи для УГИБ, поступают в больницу с этим основным диагнозом ( 2 ).
В этом документе будут рассмотрены пациенты с проявлениями явной UGIB, которые включают гематемезис (рвота красной кровью или материалом кофейной гущи), мелена (черный дегтеобразный стул) или гематохезия (прохождение красного или темно-бордового материала через прямую кишку). Мы рассмотрим начальное ведение всей популяции пациентов с UGIB до эндоскопической оценки включительно. Мы ограничим наши рекомендации относительно эндоскопической терапии и постендоскопического лечения пациентами с язвенным кровотечением, наиболее частой причиной UGIB и диагнозом, для которого проводились большинство рандомизированных контролируемых исследований (РКИ) терапии.
МЕТОДЫ
Члены комиссии при участии Комитета по параметрам практики Американского колледжа гастроэнтерологии (ACG) сформулировали клинически уместные конкретные вопросы, связанные с ведением острого эпизода UGIB, и сформулировали каждый вопрос в формате PICO (популяция, вмешательство, компаратор и исход). . Формат PICO включает популяцию, к которой относится вопрос и формулировку рекомендаций (например, пациенты с UGIB), оцениваемое вмешательство или действие (например, ингибитор протонной помпы [PPI]), компаратор, с которым сравнивается вмешательство (например, плацебо). и интересующие исходы (например, дальнейшее кровотечение). Для каждого PICO был проведен систематический поиск англоязычной литературы в библиографических базах данных (включая Embase, Ovid MEDLINE и ISI Web of Science) с момента создания базы данных до октября 2019 года. Любая цитата, определенная членом группы как потенциально релевантная после двойной независимой проверки названий и аннотаций, была извлечена в полной форме для рассмотрения комиссией. Были проведены поиск РКИ и метаанализов РКИ. Наблюдательные исследования проводились только тогда, когда РКИ, непосредственно посвященные PICO, не были доступны. Мы не полагались на тезисы, опубликованные> 5 лет до октября 2019 года, или на промежуточные результаты, представленные без последующей публикации в полной форме. Также были рассмотрены соответствующие исследования из обзора списков литературы найденных или известных авторам рукописей. Критическим исходом было дальнейшее кровотечение, которое включало постоянное и повторяющееся кровотечение.3 ). Смертность была определена как важный результат, но не критический для принятия решения, поскольку смерть у пациентов с UGIB встречается редко (~ 2% в США ( 2 )), а размеры выборки для большинства РКИ не основаны на оценке смертности. Другие потенциальные исходы (например, продолжительность госпитализации и хирургического вмешательства) были заранее определены для некоторых отдельных PICO. Мета-анализы, выполненные для этого руководства (фиксированный эффект, если I 2 <50%; случайные эффекты, если I 2 ≥ 50%), а также расчеты отношения рисков (RR) и абсолютной разницы рисков для отдельных исследований были выполнены с помощью программного обеспечения RevMan версии 5.3. (Кокрановское сотрудничество, Копенгаген, Дания).
Каждая рекомендация включает оценку силы рекомендации и качества доказательств на основе методологии GRADE ( 4,5), за которым следует сводка доказательств с изложением основных данных и соображений, лежащих в основе рекомендации. Качество доказательств оценивается по 4 категориям. «Высокое» качество означает, что мы уверены, что истинный эффект близок к оценке эффекта. «Умеренный» означает, что мы умеренно уверены в оценке эффекта: истинный эффект, вероятно, будет близок к оценке эффекта, но, возможно, существенно отличается. «Низкий» означает, что наша уверенность в оценке эффекта ограничена, а истинный эффект может существенно отличаться. «Очень низкий» означает, что у нас очень мало уверенности в оценке эффекта, и истинный эффект, вероятно, будет существенно отличаться. Степень доказательности, предоставляемая с каждым утверждением, основана на критическом исходе, дальнейшем кровотечении, если не указано иное. Сила рекомендации отражает уровень уверенности в том, что желаемые эффекты от действия перевешивают нежелательные, и основана на качестве доказательств эффективности, безопасности, ценностей и предпочтений пациентов, доступности и использования ресурсов. «Сильные» рекомендации начинаются со слов «мы рекомендуем» и даются, когда мы уверены, что желаемые эффекты от действия явно перевешивают нежелательные. Сильные рекомендации подразумевают, что наиболее информированные пациенты выберут рекомендованное лечение, а клиницисты должны предоставить вмешательство большинству пациентов. «Условные» рекомендации начинаются со слов «мы предлагаем» и указывают на то, что желательные и нежелательные эффекты действия хорошо сбалансированы или существует значительная неопределенность в отношении баланса. В этом случае информированные пациенты выбор будет варьироваться в зависимости от их ценностей и предпочтений, при этом многие не хотят вмешательства; Выбор информированных врачей также может варьироваться, и они должны обеспечить учет ценностей и предпочтений своих пациентов при принятии решений относительно ведения.
Каждый PICO, за которым следует таблица доказательств, в которой суммируются доказательства и классификация качества доказательств из соответствующих исследований для этого PICO, приводится в дополнительных материалах (см. Дополнительный цифровой контент, http://links.lww.com/AJG / B962 ). Список руководящих положений представлен в Таблице 1 .
Таблица 1.
Таблица 1.: Список руководящих положений с указанием силы рекомендации и качества доказательств
РЕКОМЕНДАЦИИ
Стратификация риска
1. Мы предлагаем пациентам, поступающим в отделение неотложной помощи с UGIB, которые классифицируются как очень низкий риск, определяемый как оценка риска с частотой ложноотрицательных результатов ≤1% для исхода госпитального вмешательства или смерти (например, Glasgow-Blatchford балл = 0–1), выписываться с амбулаторным наблюдением, а не госпитализироваться (условная рекомендация, доказательства очень низкого качества).
Резюме доказательств.
Цель выявления пациентов с очень низким уровнем риска - позволить подгруппе пациентов безопасно выписаться из отделения неотложной помощи с последующим амбулаторным наблюдением, тем самым снижая затраты с небольшой вероятностью или нулевой вероятностью того, что пациенты будут подвергаться риску неблагоприятных исходов, требующих или могло быть предотвращено с помощью стационарного лечения. Таким образом, основная польза от этой рекомендации - экономическая из-за меньшего количества госпитализаций.
Комбинированные исходы обычно используются в исследованиях оценок риска ( 6–10 ). Мы полагались в первую очередь на составные исходы, как они определены в рассмотренных нами исследованиях, считая их предпочтительнее единичных исходов в виде дальнейшего кровотечения или смертности для выявления пациентов с очень низким риском. Комбинированный результат в 4 отдельных исследованиях, которые мы оценили, включал госпитальные вмешательства по поводу кровотечения (переливание крови и гемостатическая терапия) и смерти ( 6-8,10 ), в то время как систематический обзор других исследований дополнительно включал повторное кровотечение, ведущее к повторной госпитализации, в их комбинированный исход ( 9 ) (см. Дополнительную таблицу 1.2, дополнительный цифровой контент, http://links.lww.com/AJG/B962 ).
Достижение высокой чувствительности, которая сводит к минимуму ложноотрицательные результаты, является ключевым моментом при принятии решений относительно амбулаторного лечения. Ложноотрицательные результаты возникают, когда пациенты, которым потребуется вмешательство или умрут, неправильно классифицируются инструментом оценки риска как не требующие вмешательства или умирающие. Это может привести к выписке пациента, который потребует вмешательства или умрет. Целью не будет ложноотрицательных результатов (100% чувствительность), но медицинские работники и пациенты могут определить уровень уверенности, необходимый, чтобы чувствовать себя комфортно при выписке из отделения неотложной помощи.
Пациенты с баллом Глазго-Блатчфорда (GBS, Таблица 2 ), равным 0, имеют точечную оценку чувствительности 99% –100% с нижними границами 95% доверительного интервала (ДИ) 98% ( 7–9 ), хотя специфичность низкая. точечные оценки варьируются от 8% до 22% (см. дополнительную таблицу 1.2, дополнительный цифровой контент, http://links.lww.com/AJG/B962 ). Пациенты с GBS = 0–1 имеют оценку точки чувствительности 99% с нижним пределом 95% ДИ 97–98% ( 7,8 ); специфичность выше с точечными оценками от 27% до 40%. Два крупных многоцентровых исследования сообщили о GBS = 0–1 у 19–24% пациентов с UGIB ( 6,7 ). Недавняя модель машинного обучения от Shung et al. ( 8) можно настроить для обеспечения чувствительности 99% (сопоставимо с GBS = 0–1) или 100% (сопоставимо с GBS = 0) со специфичностью выше, чем GBS.
Таблица 2.
Таблица 2.: Глазго-Блатчфорд счет
На рисунке 1 показан расчет чувствительности и специфичности для гипотетической когорты из 250 пациентов с UGIB с использованием порога GBS, равного 1, для выявления пациентов с очень низким риском. Чувствительность 99% означает, что на каждые 100 из этих пациентов, которым потребуется вмешательство в больнице или которые умрут, будет 1 ложноотрицательный результат, т. Е. 1 пациент с СГБ = 0–1 ошибочно классифицируется как не требующий вмешательства или умирающий. Как уже упоминалось, специфичность низкая при высокой чувствительности. фигура 1показывает, что среди 150 пациентов, которым не потребуется вмешательство или смерть, только 50 правильно классифицированы по шкале GBS = 0–1 (специфичность 33%, частота ложноположительных результатов 67%). Таким образом, большинство пациентов, которые не нуждаются в вмешательстве или умирают и которым, вероятно, не поможет госпитализация, не относятся к группе очень низкого риска. Повышение специфичности при сохранении высокой чувствительности - ключевая цель при разработке новых моделей оценки риска.
Фигура 1.
Фигура 1.: Таблица два на два для определения чувствительности и специфичности для гипотетической популяции из 250 пациентов с кровотечением из верхних отделов желудочно-кишечного тракта с использованием порогового значения по шкале Глазго-Блатчфорда, равного 1. Верхняя строка включает пациентов с баллами> 1, а нижняя строка включает пациентов с баллами 0–1 (определяется как очень низкий риск). В левом столбце показаны 100 пациентов, которым потребуется вмешательство в больнице или они умрут, с чувствительностью, рассчитанной по формуле истинно положительных результатов, разделенных на общее количество пациентов, которым требуется вмешательство или которые умирают (99/100 = 99%). В правом столбце показаны 150 пациентов, которым не потребуется вмешательство в больнице или они умрут, со специфичностью, рассчитанной по формуле «истинно отрицательные», деленной на общее количество, не требующее вмешательства или умирающих (50/150 = 33%).
Фигура 2.
Фигура 2.: Первоначальное ведение пациентов с явным кровотечением из верхних отделов желудочно-кишечного тракта. a Будущие инструменты оценки риска могут использоваться, если шкала определяет риск переливания, гемостатического вмешательства или смерти с чувствительностью 99–100% (ложноотрицательные результаты 0–1%). RBC, эритроцит.
Рисунок 3.
Рисунок 3 .: Эндоскопическая и медикаментозная терапия язвенного кровотечения на основе эндоскопических особенностей язвы. a Для непрерывного режима рекомендуется болюс 80 мг с последующей инфузией 8 мг / мин в течение 3 дней. Для прерывистых схем рекомендуются дозы 40 мг 2–4 раза в день в течение 3 дней, если возможно, вводить перорально, и может быть целесообразным начальное болюсное введение 80 мг. b Стандартная терапия ИПП (например, пероральный ИПП один раз в день) рекомендована предыдущими руководствами ( 1,37 ), но не оценивается в текущем документе. ИПП, ингибитор протонной помпы.
Группа рассмотрела, является ли чувствительность ниже 100% приемлемой, и пришла к выводу, что стремление к чувствительности 99% было разумным, поскольку большая специфичность при несколько меньшей чувствительности позволяет выписать большее количество пациентов. Два инструмента стратификации риска, по-видимому, обеспечивают чувствительность 99% (с нижней границей 95% доверительного интервала 97–98%): GBS = 0–1 и модель машинного обучения Шунга (см. Дополнительную таблицу 1.2, Дополнительный цифровой контент, http: //links.lww.com/AJG/B962). Группа упомянула только GBS в рекомендации, потому что GBS широко изучался в различных условиях, в то время как модель Шунга в настоящее время оценивалась только в одном параметре. Важно отметить, что предлагаемый порог в 1% ложноотрицательных результатов (чувствительность 99%) для исхода госпитального вмешательства или смерти служит руководством для оценки прогностических моделей, разработанных в будущем. Предпочтения пациента и медицинского работника относительно уверенности в риске и желания амбулаторного или стационарного лечения должны играть важную роль при принятии решений относительно пороговых значений. Решения необходимо принимать индивидуально, исходя из возраста пациента, сопутствующих заболеваний, надежности, социальной поддержки и доступности медицинской помощи после выписки.
Хотя обсервационные исследования предполагают, что GBS и модель машинного обучения выявляют пациентов с очень низким риском и высокой чувствительностью, мало доказательств того, что выписка таких пациентов из отделения неотложной помощи при амбулаторном ведении действительно может быть выполнена с небольшим риском или без него по сравнению с госпитализацией. такие пациенты. Было выявлено только одно исследование, соответствующее критериям этого PICO: исследование до и после ( 10 ) (см. Дополнительную таблицу 1.1, дополнительный цифровой контент, http://links.lww.com/AJG/B962). До введения правила, согласно которому пациенты с GBS = 0 не будут госпитализированы, кроме случаев, когда это необходимо по другим причинам, 0 из 105 пациентов с GBS = 0 потребовалось стационарное вмешательство (переливание крови, эндоскопическая или хирургическая терапия) или умерли в течение 30 дней. После внедрения правила 0 из 84 пациентов с СГБ = 0, которые не были госпитализированы, потребовали стационарного вмешательства или умерли при последующем наблюдении ( 10 ). Кроме того, в ретроспективной серии случаев было отмечено, что после начала протокола, в котором пациенты с острым UGIB и GBS = 0–1 будут выписаны из отделения неотложной помощи с амбулаторной помощью, если нет других причин для госпитализации, 0 из 103 пациентов с GBS = 0–1 выписанный потребовал госпитального вмешательства или умер в течение 30 дней ( 11 ).
Заключение.
Использование инструмента оценки риска для выявления пациентов с риском переливания крови, гемостатического вмешательства или смерти ≤1%, которые могут быть выписаны при амбулаторном лечении, должно снизить количество госпитализаций и затраты. GBS = 0–1 должен соответствовать этому требованию и позволять выписывать больше пациентов, чем GBS = 0, что было пороговым значением, предложенным в Рекомендациях ACG 2012 г. ( 1 ).
Переливание эритроцитов
2. Мы предлагаем ограничительную политику переливания эритроцитов (эритроцитов) с порогом переливания при гемоглобине 7 г / дл для пациентов с UGIB (условная рекомендация, доказательства низкого качества).
Резюме доказательств.
Для общей популяции пациентов с анемией, не ограничиваясь UGIB, текущие руководящие принципы США настоятельно рекомендуют ограничительный порог трансфузии эритроцитов 7 г / дл у госпитализированных гемодинамически стабильных пациентов, включая пациентов интенсивной терапии, и порог 8 г / дл. dL у тех, кто подвергается ортопедическим или кардиохирургическим операциям, а также у тех, у кого есть сердечно-сосудистые заболевания ( 12). В рекомендациях указывалось, что порог в 7 г / дл, вероятно, сравним с 8 г / дл, но данные рандомизированного исследования были доступны не для всех категорий пациентов; доказательств было сочтено недостаточным для рекомендации пациентам с острым коронарным синдромом. Эти рекомендации были основаны на систематическом обзоре, показывающем, что ограничительная трансфузионная политика снизила количество пациентов, получающих переливание эритроцитов, на 43% без каких-либо доказательств влияния на клинически важные результаты ( 13 ).
Два РКИ соответствовали нашим критериям оценки ограничительной и либеральной политики переливания крови в UGIB ( 14,15 ) ( таблица 3 , см. Дополнительную таблицу 2.1, дополнительный цифровой контент, http://links.lww.com/AJG/B962 ). Villaneuva et al. ( 14 ) провели рандомизированное сравнение пороговых значений 7 г / дл и 9 г / дл у 899 пациентов с 45-дневной смертностью в качестве основного результата. Пациенты с массивным кровотечением и пациенты с симптоматической периферической васкулопатией, инсультом или транзиторной ишемической атакой в предыдущие 90 дней были исключены. Переливание было менее распространено в рестриктивной группе (49% против 86%, P <0,001). Ограничительная группа имела более низкую смертность (5% против 9%, P= 0,02; скорректированное отношение рисков [HR] = 0,55, 95% ДИ 0,33–0,92), меньшее количество последующих кровотечений (10% против 16%, P = 0,01; скорректированный HR = 0,68, 0,47–0,98) и меньшее количество трансфузионных реакций (3% против 9 %, P = 0,001) и сердечных осложнений (11% против 16%, P = 0,04) ( Таблица 3 ).
Таблица 3.
Таблица 3 .: Результаты рандомизированных исследований ограничительной и либеральной стратегии переливания крови
Jairath et al. ( 15 ) провели кластерное рандомизированное исследование, в котором участвующие центры, а не отдельные пациенты, были случайным образом распределены в группу исследования. Три больницы были отнесены к порогу 8 г / дл и 3 больницы к порогу 10 г / дл, с обескровливающим кровотечением в качестве единственного критерия исключения. Набор участников был выше в группе либеральной политики с неравномерным распределением участников в группы ограничительного и либерального исследования (43% против 57%); также были отмечены свидетельства потенциальной систематической ошибки отбора. Разница в доле получающих переливание крови между ограничительной и либеральной группами была меньше, чем можно было бы ожидать (33% против 46%, P= 0,23), вероятно, по крайней мере частично из-за более низкой приверженности политике переливания крови в либеральной группе. Различия между ограничительной и либеральной политикой не были значительными в отношении 28-дневной смертности (5% против 7%), дальнейшего кровотечения (5% против 9%), трансфузионных реакций (1% против 2%) или тромбоэмболических / ишемических событий (4%). против 7%) ( таблица 3 ).
Основываясь на приведенных выше доказательствах, комиссия предложила ограничительную политику переливания крови. Порог переливания при гемоглобине 7 г / дл (т. Е. Переливание, проводимое, когда гемоглобин падает ниже 7 г / дл), был выбран, потому что РКИ, демонстрирующее пользу рестриктивного переливания в UGIB, использовало порог 7 г / дл ( 14 ). Кроме того, метаанализ РКИ с участием пациентов с любыми показаниями к переливанию не выявил значительных различий во влиянии на смертность при ограниченном и либеральном переливании крови между подгруппами РКИ с использованием ограничительного порога 8-9 г / дл (RR = 1,05, 0,78). –1,40), а в подгруппе - 7 г / дл (RR = 0,94, 0,74–1,19) ( 13 ).
Учитывая исключение обескровливаемого UGIB из этих РКИ и знание того, что уровень гемоглобина у пациентов с гипотензией будет ниже после инфузионной реанимации даже при отсутствии дальнейшего кровотечения, группа согласилась с тем, что пациентам с гипотензией целесообразно переливать кровь до того, как уровень гемоглобина достигнет 7 г / дл . Учитывая нехватку данных рандомизированных исследований у пациентов с UGIB и ранее существовавшим сердечно-сосудистым заболеванием, а также текущую рекомендацию использовать 8 г / дл у пациентов с ранее существовавшим сердечно-сосудистым заболеванием, группа согласилась с тем, что этот порог является разумным для пациентов с UGIB и до -существующие сердечно-сосудистые заболевания. Эту популяцию следует дифференцировать от пациентов с острым коронарным синдромом. Доказательства в последнем очень ограничены,13,16,17 ). Таким образом, пороговое значение выше 8 г / дл может рассматриваться у пациентов с UGIB и острым коронарным синдромом на основании очень ограниченных доказательств.
Заключение.
Ограничительная политика переливания эритроцитов, при которой пациенты переливаются при падении гемоглобина ниже 7 г / дл, по-видимому, снижает вероятность дальнейшего кровотечения и смерти, что не изменилось в рекомендациях ACG 2012 г. ( 1 ). Пациентам с гипотензией можно переливать кровь при более высоком уровне гемоглобина при условии уравновешивания, которое происходит при реанимации жидкости, и порог в 8 г / дл является приемлемым для пациентов с ранее существовавшим сердечно-сосудистым заболеванием.
Преэндоскопическая медикаментозная терапия
Прокинетическая терапия эритромицином.
3. Мы предлагаем инфузию эритромицина перед эндоскопией пациентам с UGIB (условная рекомендация, доказательства очень низкого качества).
Резюме доказательств.
Обоснование использования прокинетического агента, такого как эритромицин, состоит в том, чтобы продвигать кровь и сгусток дистально от верхних отделов желудочно-кишечного тракта и улучшать визуализацию при эндоскопии, тем самым повышая диагностическую ценность. В идеале повышение диагностической эффективности улучшило бы клинически важные исходы, такие как дальнейшее кровотечение, за счет увеличения доли пациентов, получающих соответствующее лечение (например, эндоскопическую терапию и медикаментозное лечение) на основании результатов эндоскопии. Группа также заранее определила другие потенциально значимые преимущества: сокращение повторных эндоскопий (если правильный диагноз ставится чаще при индексной эндоскопии) и сокращение срока пребывания в больнице (более частые диагнозы при индексной эндоскопии могут позволить более раннюю выписку пациентов с низким риском Выводы,
Наш поиск выявил систематический обзор 8 РКИ ( 18 ) и 1 дополнительное РКИ, опубликованное после систематического обзора, в которое вошли 29 пациентов, которым назначен эритромицин или промывание желудка ( 19 ) ( таблица 4 , см. Дополнительную таблицу 3.1, дополнительный цифровой контент, http: //links.lww.com/AJG/B962 ). Только 1 из этих 9 РКИ предоставил результаты для нашего критического исхода дальнейшего кровотечения ( 19 ): 1/14 (7,1%) с эритромицином против 2/15 (13,3%) с промыванием желудка; разница = −6%, от −28% до 16%. Результаты смертности были предоставлены в 3 РКИ с нашим метаанализом этих исследований для эритромицина по сравнению с плацебо / отсутствием лечения, показав RR = 0,81, 0,41–1,60 ( 20–22). Метаанализ 8 РКИ документально подтвердил снижение потребности в повторной эндоскопии (отношение шансов [OR] = 0,51, 0,34–0,77) и количество дней госпитализации (средняя разница = –1,75, –2,43 до –1,06) ( 18 ). Единицы перелитой крови, как правило, были ниже при использовании эритромицина (средняя разница = -1,06, от -2,24 до 0,13 со значительной неоднородностью [ I 2 = 89%]) ( 18 ).
Таблица 4.
Таблица 4 .: Рандомизированные испытания преэндоскопической инфузии эритромицина по сравнению с отсутствием эритромицина или плацебо: результаты систематического обзора и метаанализов
Несмотря на отсутствие доказательств того, что эритромицин снижает дальнейшее кровотечение и смертность, эритромицин значительно сокращает количество повторных эндоскопий и продолжительность госпитализаций: например, верхняя граница 95% доверительного интервала предполагала уменьшение количества госпитализаций по крайней мере на 1 день. Экономическая выгода от сокращения процедур и продолжительности пребывания в больнице, а также предполагаемое желание пациентов избегать дополнительных процедур и дней пребывания в больнице, относительно низкая стоимость и простота введения, привели группу к условной рекомендации по использованию преэндоскопического эритромицина. Имеющиеся доказательства (критерии включения в РКИ) не предполагали, что польза была ограничена определенной подгруппой пациентов с острой UGIB. Доказательств оценки прокинетического агента метоклопрамида немного, они получены только из более старых выдержек.23–25 ).
Рекомендуется внутривенное вливание 250 мг, потому что эта или аналогичная доза чаще всего использовалась в РКИ. Инфузия проводилась в течение 5–30 минут (чаще всего 20–30 минут), а через 20–90 минут проводилась эндоскопия ( 18,19 ). Внутривенный эритромицин может удлинять интервал QT, с эффектом, связанным со скоростью инфузии и дозой, и очень редко связан с желудочковыми тахиаритмиями, такими как torsade de pointes. Однако обзор отчетов показывает, что это происходит при повторных и / или более высоких дозах ( 26,27). Тем не менее, некоторые, но не все исследования исключали пациентов с факторами, которые потенциально повышают риск пуантах, которые могут включать удлинение интервала QT на исходной электрокардиограмме, сердечные заболевания, электролитные нарушения, печеночную дисфункцию, одновременную антиаритмическую терапию и препараты, удлиняющие интервал QT. интервала и являются субстратами CYP3A4 (например, терфенадин и астемизол) ( 19,20,22,26,28,29 ).
Заключение.
Инфузия 250 мг эритромицина за 20–90 минут до эндоскопии может уменьшить потребность в повторной эндоскопии и продолжительность госпитализации, хотя документально не подтверждено улучшение клинических исходов, таких как дальнейшее кровотечение. В Руководстве АЧГ 2012 г. указано, что такая инфузия «следует рассмотреть» ( 1 ).
ИПП-терапия.
4. Мы не смогли дать рекомендации за или против преэндоскопической терапии ИПП для пациентов с UGIB.
Резюме доказательств.
Систематический обзор выявил 3 плацебо-контролируемых РКИ по оценке преэндоскопической терапии ИПП ( 30–32 ) (см. Дополнительную таблицу 4.1, дополнительный цифровой контент, http://links.lww.com/AJG/B962 ). Однако в 2 из этих испытаний ( 30,31), все пациенты остались в группе назначенного лечения (плацебо или ИПП) после эндоскопии. Поскольку стандартная практика требует терапии ИПП у пациентов с язвами, эти 2 исследования не соответствуют современной клинической практике. Этот дизайн исследования также является методологически проблематичным, потому что, если пациенты в группе плацебо, которым требуются ИПП, остаются на плацебо после эндоскопии, в то время как пациенты в группе ИПП получают ИПП после эндоскопии, вносится смещение в пользу групп ИПП. Таким образом, эти 2 исследования не позволяют оценить постэндоскопические конечные точки, такие как дальнейшее кровотечение и смертность, что заставляет группу полагаться исключительно на исследование Lau et al. для этих результатов. Все 3 исследования использовались для оценки исходов до момента эндоскопии, таких как необходимость эндоскопического лечения.
Lau et al. ( 32 ) не обнаружили доказательств пользы ИПП (внутривенный омепразол, болюс 80 мг с последующей инфузией 8 мг / час) по сравнению с плацебо при дальнейшем кровотечении (11/314 [3,5%] против 8/317 [2,5%]; разница = 1%, от -2 до 4%) или смертности (8/314 [2,5%] против 7/317 [2,2%]; разница = 0%, от -2 до 3%) ( Таблица 5 ). Точно так же наш метаанализ двух других исключенных исследований ( 30,31 ) не показал улучшения в отношении дальнейшего кровотечения или смертности, несмотря на предвзятость в отношении терапии ИПП. Наш метаанализ 3 исследований ( 30–32 ) выявил снижение эффективности эндоскопического гемостатического лечения при индексной эндоскопии с ИПП по сравнению с плацебо (ОР = 0,73, 0,57–0,94), что, вероятно, связано с более низкой частотой стигматов высокого риска недавнего кровотечения при эндоскопии. .
Таблица 5.
Таблица 5 .: Двойное слепое плацебо-контролируемое рандомизированное исследование болюсного введения омепразола с последующей непрерывной инфузией, начатое перед эндоскопией у пациентов, поступающих в отделение неотложной помощи с гематемезисом или меленой ( 32 )
Таким образом, ограниченные доказательства низкого качества свидетельствуют об отсутствии пользы от преэндоскопической терапии ИПП в отношении дальнейшего кровотечения или смертности, хотя ДИ для этих исходов широки. Ввиду отсутствия доказательств клинической пользы группа экспертов не смогла рекомендовать преэндоскопическую терапию ИПП. Тем не менее, группа экспертов не рекомендовала отказываться от преэндоскопической терапии ИПП из-за неточности доказательств и других очень косвенных доказательств. Данные рандомизированного исследования (см. Утверждение 13) показывают, что постендоскопическая терапия высокими дозами ИПП снижает дальнейшее кровотечение после эндоскопической терапии у пациентов с язвами со стигматами высокого риска ( 33 ) и у пациентов с язвами с прилипшими сгустками, не получавших эндоскопической терапии ( 34, 35 год), что повышает вероятность того, что преэндоскопическая терапия ИПП может дать некоторые преимущества у меньшинства пациентов с UGIB. Кроме того, пациентам, которые не будут проходить эндоскопию и эндоскопическую гемостатическую терапию или у которых она будет отложена, группа сочла, что преэндоскопическая терапия ИПП может быть назначена на основе очень косвенных данных метаанализа РКИ у пациентов, которые не последовательно получать эндоскопическую гемостатическую терапию, которая показала снижение повторного кровотечения (OR = 0,38, 0,18–0,81), но не смертность, с ИПП по сравнению с плацебо или антагонистом гистаминовых 2-рецепторов (H2RA) ( 36 ).
Преэндоскопическая терапия ИПП может несколько снизить потребность в эндоскопическом лечении. Медицинские работники и пациенты, которые придают большое значение снижению потребности в эндоскопической терапии, могут предпочесть преэндоскопическую терапию ИПП. Экономические соображения также будут различаться в разных местах здравоохранения: дополнительная стоимость терапии ИПП для всех пациентов с UGIB по сравнению со снижением стоимости за счет отказа от эндоскопической терапии у небольшого числа пациентов может повлиять на решения. Экономический анализ был идентифицирован, но не включен, поскольку в моделях не использовались данные о первичных клинических исходах, представленные Lau et al. в анализе эффективности.
Заключение.
Имеющиеся данные указывают на отсутствие пользы от преэндоскопической терапии ИПП для клинических исходов, что не позволяет рекомендовать ее использование. Учитывая умеренное сокращение эндоскопической терапии и недоказанную возможность того, что ИПП могут принести пользу избранному меньшинству пациентов и / или тем, у кого эндоскопическая терапия недоступна или откладывается, мы не рекомендовали ее использование. В других руководствах приводятся весьма вариативные утверждения, от рекомендаций ( 37 ) до рекомендаций ( 38 ) против ( 38 ) преэндоскопической терапии ИПП. В предыдущих рекомендациях мы указали, что преэндоскопическая терапия ИПП может рассматриваться как уменьшение потребности в эндоскопической терапии, но не улучшает клинические исходы ( 1,39). Однако с тех пор сформировался консенсус относительно надлежащего способа представления рекомендаций. В руководствах должны быть указаны рекомендуемые действия ( 40 ). Следовательно, такие утверждения, как «может быть рассмотрен», которые не рекомендуют за или против таких действий, как назначение терапии ИПП, больше не используются.
Эндоскопия для УГИБ
Сроки эндоскопии.
5. Мы предлагаем пациентам, госпитализированным или находящимся под наблюдением в больнице по поводу UGIB, пройти эндоскопию в течение 24 часов с момента обращения (условная рекомендация, доказательства очень низкого качества).
Резюме доказательств.
Раннего диагноза недостаточно, чтобы оправдать раннюю эндоскопию; требуется доказательство пользы клинических, экономических или ориентированных на пациента результатов. Потенциальные преимущества ранней эндоскопии включают более точный прогноз для руководства (например, время возобновления кормления и выписки) и более раннее проведение эндоскопической или медикаментозной терапии на основании результатов эндоскопии ( 41 ). Потенциальный вред может включать смерть или осложнения, если эндоскопия выполняется до соответствующей реанимации и лечения активных сопутствующих заболеваний, а также более неблагоприятные исходы при эндоскопии в нерабочее время.
Группа рассмотрела исследования в общей популяции пациентов с UGIB, а также в исследованиях, ограниченных пациентами с клиническими признаками, предсказывающими низкий или высокий риск дальнейшего кровотечения и смерти. Это заявление было ограничено пациентами, которые были госпитализированы или помещены в больничное отделение наблюдения. Пациенты с очень низким риском, выписанные из отделения неотложной помощи с амбулаторным наблюдением (обсуждаются в Заявлении 1), не рассматривались. Наблюдательные исследования были включены из-за отсутствия РКИ, непосредственно посвященных PICO. Поскольку фундаментальные различия, вероятно, существуют в важных характеристиках, которые могут повлиять на результаты между пациентами, которые получают и не получают раннюю эндоскопию в нерандомизированных исследованиях,
Все население с УГИБ.
Ни в одном РКИ не оценивалась эндоскопия в течение 24 часов против> 24 часов, хотя в РКИ сравнивалась эндоскопия, выполненная ≤12 часов против> 12 часов после представления у последовательных пациентов с UGIB ( 42 ) (см. Дополнительную таблицу 5.1, дополнительный цифровой контент, http: // ссылки .lww.com / AJG / B962 ). Авторы сообщили о результатах только у пациентов с эндоскопически подтвержденным кровотечением из язвы и не обнаружили снижения дальнейшего кровотечения (6/162 [3,7%] против 8/163 [4,9%]) или смертности (1/162 [0,6%] против 1/163). [0,6%]). Доказательства очень низкого качества, полученные в результате обсервационных исследований, предполагают, что пациенты, госпитализированные с UGIB, которые проходят эндоскопию в течение 1 дня после поступления, имеют более короткое пребывание в больнице ( 43–45 ), чем те, кто этого не делает. Два из этих наблюдательных исследований ( 43,45) выявили более низкий риск хирургического вмешательства, а другой сообщил о снижении смертности при эндоскопии в течение 1 дня после госпитализации ( 46 ). Неясно, действительно ли эндоскопия, указанная в исследованиях базы данных как в течение 1 дня после поступления, была проведена в течение 24 часов после поступления; некоторые потенциально могут возникнуть на следующий календарный день после 24 часов после поступления ( 44–46 ).
Клинические признаки низкого риска.
Два небольших РКИ с участием пациентов с клиническими признаками низкого риска (гемодинамически стабильными без тяжелых сопутствующих заболеваний) показали, что эндоскопия в течение 2–6 часов после первоначальной оценки выявила эндоскопические данные низкого риска (например, чистая язва, некровоточащая слеза Мэллори-Вейсса) это должно позволить выписку с амбулаторным наблюдением не менее 40% пациентов ( 47,48 ) (см. дополнительную таблицу 6.1, дополнительный цифровой контент, http://links.lww.com/AJG/B962 ). Снижение объема стационарной помощи было выявлено только в одном из этих исследований ( 48 ), поскольку во втором исследовании лечащие врачи не следовали рекомендациям эндоскопистов в отношении амбулаторной помощи примерно у 80% пациентов с эндоскопическими данными низкого риска ( 47).). Различий в дальнейшем кровотечении или летальности не выявлено. Поскольку ни в одном РКИ не проводилась оценка эндоскопии в течение 24 часов по сравнению с более чем 24 часами, мы также рассмотрели большое когортное исследование 5415 гемодинамически стабильных пациентов без значительных сопутствующих заболеваний (оценка 1–2 Американского общества анестезиологов) с эндоскопически задокументированными кровоточащими язвами ( 49 ). Эндоскопия в течение 24 часов с момента поступления показала тенденцию к снижению внутрибольничной смертности (скорректированный OR = 0,59, 0,33–1,05), но не 30-дневной смертности (скорректированный OR = 1,02, 0,50–2,09).
Клинические особенности высокого риска.
Предыдущие руководящие принципы предлагали рассмотреть возможность проведения эндоскопии в течение 12 часов у пациентов с особенностями высокого риска, такими как гемодинамическая нестабильность ( 1,37,50 ) или цирроз печени ( 51 ), хотя подтверждающие данные крайне ограничены (см. Дополнительную таблицу 7.1, дополнительный цифровой контент, http : //links.lww.com/AJG/B962 ). Выявленные релевантные исследования включали 2 обсервационных исследования с использованием статистической корректировки, и результаты были противоречивыми. Общенациональное датское когортное исследование последовательных пациентов с эндоскопически подтвержденным язвенным кровотечением выявило повышенную смертность у пациентов из группы высокого риска при очень ранней или поздней эндоскопии ( 49). Внутрибольничная летальность была ниже при эндоскопии через 6–24 часа после госпитализации у гемодинамически нестабильных пациентов и через 12–36 часов после госпитализации у гемодинамически стабильных пациентов со значительными сопутствующими заболеваниями (оценка Американского общества анестезиологов 3–5) по сравнению с эндоскопией вне этих временных рамок. Это исследование показало возможность того, что очень ранняя эндоскопия может нанести вред, если гемодинамическая реанимация и лечение других активных сопутствующих заболеваний не будут предприняты до эндоскопии. Напротив, одноцентровое корейское когортное исследование показало, что 28-дневная смертность была снижена при эндоскопии в течение 6 часов по сравнению с 6–48 часами после представления ( 52 ).
В большом РКИ, идентифицированном как реферат с промежуточными результатами 2015 года и впоследствии полностью опубликованном в 2020 году, сравнивалась срочная эндоскопия в течение 6 часов после консультации с гастроэнтерологом с контрольной группой, назначенной на эндоскопию через 6–24 часа после консультации с 516 пациентами, которые, по прогнозам, находятся в группе высокого риска. на основании GBS ≥12 ( 53 ). Ни дальнейшего кровотечения (28/258 [10,9%] против 20/258 [7,8%]; разница = 3%, от -2% до 8%), ни смертности (23/258 [8,9%] против 17/258 [6,6%]) ; разница = 2%, от -2% до 7%) была уменьшена с более ранней эндоскопией ( Таблица 6). Точно так же не было замечено никаких преимуществ в отношении продолжительности госпитализации или потребности в переливании крови, хотя эндоскопическое гемостатическое лечение проводилось на 11,6% чаще в группе экстренной эндоскопии. Из-за запаздывания от представления до рандомизации в исследовании фактически сравнивали эндоскопию через 10 и 25 часов после представления, при этом у 55% контрольной группы эндоскопия была проведена> 24 часов после представления. Эти данные повышают вероятность того, что интервалы, даже превышающие 24 часа, могут быть приемлемыми.
Таблица 6.
Таблица 6 .: Рандомизированное исследование эндоскопии <6 часов по сравнению с 6–24 часами после консультации с гастроэнтерологом у пациентов с гематемезисом или меленой и оценкой Глазго-Блатчфорда ≥12 ( 53 )
В это испытание были исключены пациенты с гипотензивным шоком, у которых не удалось стабилизироваться после первоначальной реанимации, группа, представляющая только 5% пациентов с высоким риском ( 53 ). Основываясь на анекдотическом опыте, комиссия считает, что таким пациентам требуется срочное вмешательство с помощью эндоскопии или интервенционной радиологии.
Заключение.
Панель предполагает, что пациенты, госпитализированные или находящиеся под наблюдением в больнице с явной UGIB, независимо от того, относятся ли они к группе низкого или высокого риска дальнейшего кровотечения и смерти, должны пройти эндоскопию верхних отделов тела в течение 24 часов после обращения. Это решение было основано на доказательствах потенциальной экономической выгоды (сокращение продолжительности пребывания) ( 43–45,48 ), а также возможной клинической пользы в отношении смертности и необходимости хирургического вмешательства в обсервационных исследованиях ( 43,45,46,49).). Мы решили использовать время от презентации, а не от поступления, учитывая вероятные большие различия во времени от презентации до приема в разных учреждениях. Хотя в обсервационных исследованиях, подтверждающих однодневный порог, в качестве отправной точки использовалось поступление, а не презентация, комиссия была обеспокоена тем, что учреждения с длительными задержками между представлением и приемом могут иметь неприемлемо длительные периоды для эндоскопии, если использовалось время с момента поступления. Учитывая крупное обсервационное исследование, повышающее вероятность нанесения вреда при очень ранней эндоскопии у пациентов с гемодинамической нестабильностью или значительными сопутствующими заболеваниями ( 49 ), и большое рандомизированное исследование, показывающее отсутствие пользы от очень ранней эндоскопии у пациентов с высоким риском ( 53), комиссия согласилась с тем, что реанимация и внимание к другим активным сопутствующим заболеваниям должны проводиться по мере необходимости перед эндоскопией, и не включала предложение из Руководства ACG 2012 г. о том, что эндоскопия в течение 12 часов «может рассматриваться» у пациентов с клиническими проявлениями высокого риска ( 1 ). Группа отметила, что эта практика кажется отличной от подходов к геморрагическому шоку из-за травмы, которые могут включать быстрое гемостатическое вмешательство с ограниченным введением кристаллоидов и целевыми показателями низкого артериального давления. Неясно, являются ли такие подходы эффективными в подгруппе пациентов с шоком из-за UGIB. Данные по гемодинамически стабильным пациентам без тяжелых сопутствующих заболеваний ( 47,48) поддержать эндоскопию как можно скорее в обычные часы, потому что это может позволить раннюю выписку у значительной части пациентов, у которых есть эндоскопические данные с низким риском, тем самым сокращая продолжительность госпитализации и затраты. Предлагаемое начальное ведение от момента поступления до эндоскопии показано на Рисунке 2 .
Необходимость эндоскопической гемостатической терапии язв с активным кровотечением или некровоточащих видимых сосудов.
6. Мы рекомендуем эндоскопическую терапию пациентам с UGIB из-за язв с активным истечением, активным выделением и некровоточащими видимыми сосудами (сильная рекомендация, доказательства среднего качества).
Резюме доказательств.
В метаанализе 19 РКИ 2009 г. сообщалось о заметном преимуществе эндоскопической терапии по сравнению с отсутствием эндоскопической терапии в отношении исхода дальнейшего кровотечения у пациентов с активным кровотечением (RR = 0,29, 0,20–0,43; количество, необходимое для лечения [NNT] = 2, 2– 2) и видимые сосуды без кровотечения (RR = 0,49, 0,40–0,59; NNT = 5, 4–6) ( 33 ) (см. Дополнительную таблицу 8.1, дополнительный цифровой контент, http://links.lww.com/AJG/B962 ) . Преимущество в отношении смертности не было документально подтверждено. Никаких последующих релевантных РКИ выявлено не было.
Большинство упомянутых РКИ и метаанализов объединяют струйное и сочащееся кровотечение в одну категорию «активного кровотечения». Извергающееся активное кровотечение встречается гораздо реже, чем сочится; например, в крупном проспективном исследовании сообщалось, что у 68 (17%) из 397 пациентов с активно кровоточащими язвами наблюдались спрыгивания ( 54 ). Кроме того, дальнейшее кровотечение, по-видимому, чаще встречается у пациентов со струйным течением по сравнению с активным кровотечением с мокротой ( 55,56 ). Тем не менее, дальнейшее кровотечение у пациентов с кровотечением, купированное без эндоскопической терапии, все еще достаточно велико, чтобы поддерживать рекомендацию по эндоскопической терапии. Обобщение 8 проспективных исследований, в которых участвовали пациенты с кровотечением, купировавшимся без эндоскопической терапии, выявило совокупную частоту дальнейшего кровотечения 39% (диапазон 10–100%) ( 1).). Следует отметить, что определение мокроты может широко варьироваться среди эндоскопистов. В некоторых исследованиях требуется, чтобы непрерывное кровотечение в течение 5 минут наблюдения было обозначено как активное просачивание ( 57 ), что должно снизить классификацию незначительного и преходящего кровотечения (например, после травмы прицела) как активного сочится.
Заключение.
Как указано в Рекомендациях ACG 2012 г. ( 1 ), эндоскопическая терапия обеспечивает важную клиническую пользу у пациентов с UGIB из-за язв с обнаружениями высокого риска активного кровотечения и некровоточащих видимых сосудов.
Необходимость эндоскопической гемостатической терапии язв с прилипшим сгустком.
7. Мы не смогли дать рекомендации за или против эндоскопической терапии у пациентов с UGIB из-за язв с прилипшим сгустком, устойчивым к интенсивному орошению.
Резюме доказательств.
Последний метаанализ РКИ, посвященных этому вопросу, не выявил преимущества эндоскопической терапии по сравнению с отсутствием эндоскопической терапии у пациентов со сгустками крови в отношении исходов дальнейшего кровотечения (ОР = 0,31, 0,06–1,77) или смертности (ОР = 0,90, 0,23–3,58). ) ( 33 ), и никаких последующих релевантных РКИ выявлено не было (см. Дополнительную таблицу 9.1, Дополнительный цифровой контент, http://links.lww.com/AJG/B962 ). Тем не менее, результаты дальнейшего кровотечения неоднородны, что требует более тщательной оценки отдельных испытаний.
В двух небольших РКИ УЗИ (N = 56, 32) сообщалось о высокой частоте повторного кровотечения в контрольной группе и значительном снижении при эндоскопической терапии ( 58,59 ). Ни в одном из исследований не использовалось интенсивное орошение сгустков (например, орошение с помощью водяного насоса перед тем, как было объявлено, что сгустки прилипли) или постендоскопическая терапия высокими дозами ИПП, и оба исследования были прекращены досрочно, с участием 47% и 59% предварительно определенных размеров выборки. Напротив, рандомизированное контролируемое исследование, проведенное в Гонконге с использованием интенсивной ирригации и высоких доз болюсной / непрерывной инфузии ИПП после эндоскопии, показало, что 0 из 24 пациентов, получавших ИПП без эндоскопической терапии, имели рецидивирующие кровотечения ( 35Потенциальная польза от терапии только ИПП также подтверждается двойным слепым РКИ омепразола 40 мг два раза в день по сравнению с плацебо без эндоскопической терапии в любой из групп: рецидивирующие кровотечения имели место у 0 из 64 пациентов с ИПП по сравнению с 13 (21%) пациентами. 61 получил плацебо ( 34 ). Группа не смогла идентифицировать исходные характеристики пациентов, которые позволили надежно идентифицировать подгруппу пациентов, которым эндоскопическая терапия могла бы принести пользу.
Такие вопросы, как местные эндоскопические знания и опыт, индивидуальные характеристики пациента, предпочтение эндоскопического вмешательства по сравнению с консервативным лечением и стоимость эндоскопической терапии могут играть роль в принятии решения поставщиком. Другие факторы, которые следует учитывать, - это доступность эндоскопической терапии в зависимости от локализации язвы и наличие интервенционной радиологической или хирургической поддержки, если спровоцировано неконтролируемое кровотечение. При проведении эндоскопической терапии сгустков некоторые эндоскописты используют механические манипуляции для удаления или уменьшения сгустка (например, гильотина с холодной ловушкой, наконечник гемостатического зонда). Нам неизвестны испытания, сравнивающие манипуляцию с отсутствием манипуляции или сравнивающие различные методы манипуляции для принятия решений о ее использовании.
Заключение.
Учитывая небольшой размер отдельных исследований, заметную несогласованность результатов и невозможность определить причины неоднородности исследований, группа сочла, что они не могут ни рекомендовать, ни противостоять эндоскопической терапии у пациентов с прилипшими сгустками. Группа полагала, что любой из этих методов лечения можно считать приемлемым на основании имеющихся данных. В Рекомендациях ACG 2012 г. предлагалось, чтобы эндоскопическая терапия «могла быть рассмотрена» ( 1 ), но, как отмечалось выше, такие утверждения больше не считаются приемлемыми, поскольку в руководствах должны быть указаны рекомендуемые действия ( 40 ).
Выбор эндоскопической гемостатической терапии кровоточащих язв.
8. Мы рекомендуем эндоскопическую гемостатическую терапию с биполярной электрокоагуляцией, нагревательным датчиком или инъекцией абсолютного этанола пациентам с UGIB из-за язв (сильная рекомендация, доказательства среднего качества).
9. Мы предлагаем эндоскопическую гемостатическую терапию с клипсами, коагуляцию аргоновой плазмой или мягкую монополярную электрокоагуляцию для пациентов с UGIB из-за язв (условная рекомендация, доказательства от очень низкого до низкого).
10. Мы рекомендуем использовать инъекцию адреналина не отдельно для пациентов с UGIB из-за язвы, а в сочетании с другим гемостатическим методом (сильная рекомендация, доказательства от очень низкого до среднего).
11. Мы предлагаем эндоскопическую гемостатическую терапию гемостатическим порошковым спреем TC-325 для пациентов с активно кровоточащими язвами (условная рекомендация, доказательства очень низкого качества).
12. Мы предлагаем дополнительные клипсы в качестве гемостатической терапии для пациентов, у которых развиваются рецидивирующие кровотечения из-за язв после предыдущего успешного эндоскопического гемостаза (условная рекомендация, доказательства низкого качества).
Резюме доказательств.
Мы оценили РКИ эндоскопической гемостатической терапии по сравнению с отсутствием эндоскопической терапии или по сравнению с другими формами эндоскопической терапии (см. Дополнительную таблицу 10.1, дополнительный цифровой контент, http://links.lww.com/AJG/B962). Мы исключили исследования с вторичной эндоскопией, в которых выполнялась стандартная повторная эндоскопия с повторным эндоскопическим лечением (обычно через ~ 1 день после индексной эндоскопии), поскольку это влияет на наши заранее определенные результаты (дальнейшее кровотечение и смертность) и не является рекомендуемой или стандартной практикой в США. Состояния. Кроме того, хотя определенные исходные характеристики были связаны с повышенным риском повторного кровотечения после эндоскопической терапии, мы официально не оценивали использование других профилактических методов лечения после успешной эндоскопической терапии. Тем не менее профилактическая транскатетерная артериальная эмболизация (TAE) после эндоскопического лечения не может быть рекомендована на основании РКИ с участием 241 пациента с язвами с высоким риском дальнейшего кровотечения ( 60 ).
Биполярный датчик электрокоагуляции / нагревателя.
Метаанализ 15 РКИ показал, что термоконтактные устройства для биполярной электрокоагуляции и нагревательный зонд снижают дальнейшее кровотечение (RR = 0,44, 0,36–0,54; NNT = 4, 3–5) и смертность (RR = 0,58, 0,34–0,98; NNT). = 33, 21–1000) по сравнению с отсутствием эндоскопической терапии ( 33 ) ( таблица 7 ). Методы, вероятно, схожи по эффективности: метаанализ 3 РКИ показал RR для дальнейшего кровотечения с нагревательным датчиком по сравнению с биполярной электрокоагуляцией 1,01 (95% ДИ 0,57–1,80) ( 33 ). Предыдущие рекомендации для термоконтактных устройств включают использование большого 3,2-мм зонда с устойчивым / максимальным давлением при настройках ∼15 Вт с 8-10-секундными приложениями для биполярной электрокоагуляции и 30 Дж для нагревательного зонда ( 1 ).
Таблица 7.
Таблица 7 .: Мета-анализ рандомизированных исследований, сравнивающих эндоскопическую термическую, инъекционную или зажимную терапию с отсутствием эндоскопической терапии или другой эндоскопической терапии
Склерозант для инъекций.
Мета-анализ 3 РКИ показал, что введение абсолютного этанола уменьшало дальнейшее кровотечение (RR = 0,56, 0,38–0,83; NNT = 5, 4–13) и смертность (RR = 0,18, 0,05–0,68; NNT = 9, 8–13). 24) по сравнению с отсутствием эндоскопической терапии ( 33 ) ( таблица 7 ). Обычно используются аликвоты 0,1–0,2 мл на инъекцию, при этом максимальный объем ограничивается 1–2 мл, чтобы минимизировать серьезное повреждение тканей ( 61–63 ). Другой склерозирующий агент, полидоканол, также изучался, как правило, в комбинации с адреналином. Метаанализ 6 РКИ, сравнивающих терапию адреналином плюс полидоканол в виде инъекций и отсутствием эндоскопического лечения, выявил тенденцию к меньшему количеству последующих кровотечений (ОР = 0,60, 0,36–1,00 с неоднородностью [ I 2= 58%]) и отсутствие существенной разницы в смертности (ОР = 0,80, 0,40–1,61) ( 33 ) ( таблица 7 ). Поэтому группа рекомендовала инъекции абсолютного этанола, но не рекомендовала полидоканол.
Два эндоскопических лечения с сильными рекомендациями, термоконтактная терапия с биполярной электрокоагуляцией или нагревательным датчиком и инъекция абсолютного этанола, сравнивались в 5 РКИ, и метаанализ этих исследований выявил тенденцию к уменьшению дальнейшего кровотечения при термоконтактной терапии (RR = 0,69, 0,47–1,01), основанных на доказательствах низкого качества и отсутствии значимых различий в смертности (ОР = 1,60, 0,57–4,52) ( 33 ) ( таблица 7 ). Группа не рекомендовала термоконтактную терапию вместо инъекции этанола, учитывая умеренное качество доказательств пользы этанола как для дальнейшего кровотечения, так и для смертности по сравнению с отсутствием эндоскопической терапии.
Клипы.
Доказательства для клипов менее надежны, из-за отсутствия рандомизированных сравнений с отсутствием эндоскопического лечения. Клипы сравнивали с монотерапией адреналином в 2 РКИ ( 64,65 ). Наш метаанализ этих исследований предоставил доказательства низкого качества уменьшения дальнейшего кровотечения (ОР = 0,20, 0,07–0,56) без улучшения смертности (ОР = 2,11, 0,60–7,44) с клипсами ( Таблица 7 ). Клипсы сравнивались с терапией термическим контактом в 4 РКИ, и значительных различий в отношении дальнейшего кровотечения (ОР = 1,31, 0,36–4,75) или смертности (ОР = 1,16, 0,38–3,52) выявлено не было ( 33 ) ( Таблица 7).). Таким образом, 2 РКИ, в которых использовались клипсы по сравнению с некачественной терапией (монотерапия адреналином), предоставляют косвенные доказательства низкого качества того, что клипсы более эффективны, чем отсутствие лечения при дальнейшем кровотечении. Однако, хотя РКИ, сравнивающие зажимы и термоконтактные устройства, не выявили значительных различий, доказательства были очень низкого качества, а доверительный интервал оценок лечебного эффекта был широким и не может использоваться для подтверждения эквивалентности. Таким образом, комиссия согласилась с условной рекомендацией клипов. Предыдущие рекомендации по применению зажимов включали размещение зажимов над местом кровотечения и по обе стороны от места кровотечения, чтобы попытаться закрыть нижележащую артерию ( 1 ).
Коагуляция аргоноплазмы.
Доказательства коагуляции аргоновой плазмы (APC) также менее надежны, чем для биполярной электрокоагуляции, зонда с нагревателем и абсолютного этанола. APC сравнивали с инъекцией воды в РКИ ( 66 ) с меньшим количеством последующих кровотечений (4/58 [6,9%] против 12/58 [20,7%]; разница = -14%, от -26% до -1%) и сопоставимой смертностью. (2/58 против 2/58). Было выявлено три РКИ, в которых сравнивали инъекцию АРС ± адреналин с другими методами ( 67–69 ). Наш метаанализ этих исследований не показал существенной разницы в отношении дальнейшего кровотечения (ОР = 0,82, 0,21–3,19 с гетерогенностью [ I 2 = 73%]) или смертности (ОР = 0,85, 0,30–2,44) ( Таблица 7). Группа согласилась с учетом косвенных доказательств очень низкого качества, что АРС более эффективен, чем отсутствие лечения, поскольку он вызывает меньшее кровотечение, чем некачественная терапия (инъекция воды), а также дополнительные доказательства очень низкого качества, что АРС не отличается от других методов. к условной рекомендации по APC. APC в поддерживающих РКИ выполняли с настройками потока газа 1-2 л / мин и настройками мощности 40-70 Вт для язв двенадцатиперстной кишки и желудка с расстоянием между зондом и слизистой оболочкой 2-10 мм ( 66-69 ). Рекомендуется частое отсасывание для удаления дыма и уменьшения вздутия живота.
Мягкая монополярная электрокоагуляция.
Систематический обзор 1992 г. выявил 3 РКИ, в которых монополярная электрокоагуляция сравнивалась с отсутствием эндоскопического лечения с результатами, указывающими на уменьшение дальнейшего кровотечения ( 70 ). Однако в рекомендации обычно не включается монополярная электрокоагуляция из-за предполагаемого потенциала более высокого риска нежелательных явлений с большим повреждением тканей ( 1 ). Совсем недавно модификация монополярной электрокоагуляции, режим мягкой коагуляции, была разработана для гемостаза при эндоскопической диссекции подслизистой оболочки и впоследствии применена для лечения кровоточащих язв. За счет использования непрерывной волны с максимальным снижением напряжения до 200 В обеспечивается коагуляция без карбонизации и резки ( 71) с целью повышения безопасности. Монополярные гемостатические щипцы используются для мягкой коагуляции: закрытый наконечник можно приложить к месту кровотечения, или щипцы можно использовать для захвата места кровотечения ( 71–75 ). Мягкая монополярная электрокоагуляция в РКИ выполнялась в режиме мягкой коагуляции при настройках 50–80 Вт с применением 1-2 секунд ( 72–75 ).
Поэтому мы рассмотрели мягкую монополярную электрокоагуляцию и идентифицировали 4 РКИ, сравнивая ее с другими методами (зажимы и нагревательный зонд) ( 72–75 ). Поскольку в 3 исследованиях использовалась рутинная вторичная эндоскопия, только 1 исследование можно было использовать для оценки дальнейшего кровотечения и смертности ( 75). Это сравнение мягкой коагуляции и клипс с начальной инъекцией адреналина во все активно кровоточащие язвы показало уменьшение дальнейшего кровотечения при мягкой коагуляции (3/56 [5,4%] против 19/56 [33,9%], разница = -33%, -54 % до -13%). Смертельные случаи в этом исследовании (ноль в обеих группах) и в других 3 РКИ были редкими и сходными в группах лечения. Поскольку в большинстве РКИ нельзя было полагаться на исходы дальнейшего кровотечения и смертности, мы также оценили стойкое кровотечение после гемостатической терапии при индексной эндоскопии, результат, не влияющий на результаты вторичной эндоскопии. При метаанализе 4 РКИ стойкое кровотечение имело тенденцию к снижению при мягкой коагуляции (RR = 0,35, 0,12–1,03), хотя гетерогенность присутствовала ( I 2= 61%), а качество доказательств было очень низким. В 4 РКИ у 237 пациентов, получавших мягкую коагуляцию, не было зарегистрировано серьезных побочных эффектов, таких как перфорация. Учитывая предыдущие косвенные доказательства эффективности стандартной монополярной электрокоагуляции и недавние ограниченные данные, предполагающие, что эффективность мягкой монополярной электрокоагуляции может быть, по крайней мере, такой же хорошей, как и другие гемостатические методы, группа поддержала условную рекомендацию для мягкой монополярной электрокоагуляции.
Адреналин для инъекций.
Монотерапия адреналином менее эффективна при дальнейшем кровотечении, чем стандартные монотерапии, такие как биполярная электрокоагуляция и клипсы: RR = 2,20, 1,04–4,64 со значительной гетерогенностью ( I 2 = 56%) в нашем метаанализе 4 РКИ ( 64,65,76, 77 ). Адреналин плюс второй метод более эффективен, чем монотерапия адреналином при дальнейшем кровотечении: ОР = 0,34, 0,23–0,50 в метаанализе 7 РКИ ( 33 ) ( таблица 7 ). Таким образом, группа рекомендует не использовать только адреналин. Адреналин всегда следует использовать в сочетании с другим гемостатическим средством. Адреналин чаще всего используется в разведении 1: 10 000, обычно вводится аликвотами от 0,5 до 2,0 мл.
Инъекция адреналина в сочетании с другими методами.
Группа также рассмотрела вопрос о том, следует ли всегда использовать такие средства, как термоконтактные устройства или зажимы, в сочетании с инъекцией адреналина. Эндоскописты обычно применяют адреналин у пациентов с активным кровотечением, чтобы уменьшить кровотечение и улучшить видимость перед применением другого метода, или у пациентов с некровоточащими стигматами высокого риска, чтобы предотвратить повторное кровотечение во время применения другого метода. Мета-анализ 2 небольших РКИ, сравнивающих адреналин перед биполярной электрокоагуляцией и только биполярную электрокоагуляцию, выявил меньшее количество последующих кровотечений при комбинированной терапии (ОР = 0,35, 0,18–0,71) без существенной разницы в смертности (ОР = 0,49, 0,09–2,60) ( 33). Поскольку частота дальнейшего кровотечения (25%, 34%) была необычно высокой в группах биполярной монотерапии, а доказательства среднего качества указывают на то, что биполярная электрокоагуляция или монотерапия нагревательным датчиком снижает дальнейшее кровотечение и смертность, группа экспертов не считала, что эти ограниченные данные позволяют предположить, что устройствам с тепловым контактом всегда должна предшествовать инъекция адреналина. Мета-анализ 2 небольших РКИ, сравнивающих клипы плюс адреналин и только клипы, не выявил значимых различий в отношении дальнейшего кровотечения (ОР = 1,10, 0,42–2,88) или смертности (ОР = 0,63, 0,10–3,87) ( 64,78). Однако в обоих исследованиях адреналин вводили после установки зажима. Некоторые эндоскописты используют адреналин после наложения клипсы, а не до нее, чтобы избежать локального отека при инъекции большого объема, что может затруднить наложение клипсы, или для лечения остаточного кровотечения после наложения клипсы.
Гемостатический порошок-спрей ТС-325.
Мы оценили гемостатический порошковый спрей, ограничив наш поиск продуктами, коммерчески доступными в Соединенных Штатах на момент разработки этого документа. TC-325 прилипает только к активно кровоточащим поражениям, поэтому его использование при некровоточащих поражениях, вероятно, неэффективно ( 79 ). Катетер доставки с наконечником на расстоянии 1–2 см от места кровотечения используется для нанесения TC-325 за 1-2 секунды, пока место кровотечения не будет покрыто и кровотечение не остановится.
Были идентифицированы два опубликованных РКИ, но на них не полагались, потому что оба включали рутинные вторичные эндоскопии ( 80,81 ). Нам было известно о большом РКИ от Lau et al. ( 82 ) во время поиска литературы ( Clinicaltrials.gov NCT02534571), и результаты полного исследования были впоследствии опубликованы в 2020 году. В этом рандомизированном контролируемом исследовании не меньшей эффективности TC-325 сравнивался со стандартной терапией (клипирование или контактная термокоагуляция ± предыдущая инъекция адреналина) в 224 пациента с активно кровоточащими невариксными поражениями, в том числе 130 с язвами. Их основной результат, дальнейшее кровотечение через 30 дней, произошло у 8/65 (12,3%) с TC-325 и 10/65 (15,4%) со стандартной терапией у пациентов с язвами: разница = -3%, -15% к 9 %.
Недавние руководства предложили использовать TC-325 в качестве временной меры, за которой следует использовать второй окончательный гемостатический метод ( 50,83 ). Это основано на том факте, что порошок TC-325 отслаивается со слизистой оболочки и выводится из желудочно-кишечного тракта в течение 24 часов после нанесения ( 50,79,83 ), и дальнейшее кровотечение является обычным явлением в наблюдательных исследованиях TC-325: например, 31 % (95% ДИ 26–37%) в метаанализе 18 обсервационных исследований и 2 РКИ ( 84 ). Напротив, результаты Lau et al. предполагают, что TC-325 может быть эффективным в качестве единственного агента.
Учитывая схожую частоту дальнейшего кровотечения для TC-325 по сравнению со стандартными методами лечения и 95% доверительный интервал, предполагающий не более чем на 9% более высокую скорость дальнейшего кровотечения при применении TC-325, группа экспертов сделала условную рекомендацию для гемостатического порошкового спрея TC-325 для активного кровотечения. язвы. Группа считает, что необходимы дальнейшие исследования, чтобы подтвердить, что TC-325 может использоваться в качестве монотерапии, особенно у пациентов с активным струйным кровотечением, которые составляли лишь небольшую часть пациентов в исследовании Lau et al. Учитывая, что TC-325 не превосходил другие стандартные эндоскопические гемостатические методы лечения, стоимость становится основным фактором при принятии решения о том, когда использовать TC-325. Группа предложила, чтобы в таких странах, как США, где стоимость чрезвычайно высока (прейскурантная цена в США 2500 долларов США в ноябре 2020 года), TC-325 не следует использовать в качестве исходного метода, если можно легко применить другие методы лечения. Такие факторы, как расположение и размер язвы, опыт эндоскописта и доступность лечения будут влиять на выбор первоначального метода. Экономический анализ показал, что стандартная эндоскопическая терапия с последующей терапией ТС-325 в случае неудачи стандартной терапии была доминирующей стратегией (более эффективной и менее затратной) по сравнению со стандартной терапией только ТС-325 или ТС-325 с последующей стандартной терапией, если ТС- 325 не удалось (85 ). Однако затраты на TC-325, использованные в модели, были намного меньше, чем текущие цены в США, а используемые показатели повторного кровотечения были намного выше, чем у Lau et al., Что вызывает вопросы о применимости результатов в настоящее время. Изменения в стоимости TC-325 могут повлиять на решения относительно его использования в качестве начальной терапии, а будущий экономический анализ может помочь в определении пороговых значений затрат для таких решений.
Зажимы нестандартные.
Наложение зажимов для увеличения объема выполняется аналогично эндоскопической перевязке: колпачок с одним зажимом помещается на дистальный конец эндоскопа, кровоточащий очаг приближается к очагу кровоизлияния, колпачок помещается на очаг, окружающий его, поражение всасывается в колпачок, и зажим освобождается. У пациентов с рецидивирующим кровотечением после успешного эндоскопического гемостаза в прошлом рандомизированное контролируемое исследование показало, что зажимы для увеличения продолжительности кровотечения превосходили стандартную терапию (5/33 [15,2%] против 19/33 [57,6%], разница = - 42%, от −63% до −22%) без существенной разницы в уровне смертности ( 86). Стандартные зажимы для увеличения объема использовались в 94% контрольной группы, что потенциально ограничивало возможность обобщения этого исследования в отношении сравнения зажимов для увеличения объема с другими формами гемостатической терапии.
На момент поиска литературы нам было известно о рандомизированном контролируемом исследовании клипов с дополнительным охватом для первоначального лечения UGIB ( Clinicaltrials.gov NCT03216395), и результаты были опубликованы в 2020 году. В исследовании сравнивали адреналин и дополнительные клипы. по сравнению с адреналином плюс биполярная электрокоагуляция или клипсы у пациентов с тяжелой UGIB из-за поражений Дьелафуа (N = 5) или язв (N = 48) с активным кровотечением, видимыми сосудами, сгустками или плоскими допплер-положительными пятнами ( 87). Дальнейшее кровотечение из язвы произошло у 1/23 (4%) против 7/25 (28%) (разница = -24%, -43% до -4%) без смертельных исходов. Это рандомизированное контролируемое исследование повышает вероятность использования зажимов, выходящих за рамки обследования, в качестве начального лечения. Однако ограничения исследования, приведшие к очень низкому качеству доказательств, не позволили нам изменить нашу рекомендацию относительно клипов, выходящих за рамки объема (см. Дополнительную таблицу 10.1, Дополнительный цифровой контент, http://links.lww.com/ AJG / B962 ).
Заключение.
Доказательства клинической пользы от эндоскопической терапии наиболее убедительны для устройств с тепловым контактом (биполярная электрокоагуляция и нагревательный зонд) и абсолютной инъекции этанола. Доказательства низкого или очень низкого качества также свидетельствуют о пользе клипс, APC и мягкой монополярной электрокоагуляции. Монотерапия адреналином менее эффективна, чем другие стандартные монотерапии, а также менее эффективна, чем адреналин плюс второй метод. Гемостатический порошковый спрей TC-325 кажется эффективным при активно кровоточащих язвах, хотя в настоящее время высокая стоимость может ограничивать его использование в качестве начальной эндоскопической терапии по этому показанию в Соединенных Штатах. Зажимы для увеличения объема кажутся полезными для пациентов с рецидивирующим кровотечением из язвы после предыдущего успешного эндоскопического гемостаза. По сравнению с Руководством АЧГ 2012 г. ( 1), текущие положения рекомендаций расширены за счет включения APC, мягкой монополярной электрокоагуляции, гемостатического порошкового спрея TC-325 и дополнительных зажимов.
Антисекреторная терапия после эндоскопической гемостатической терапии кровоточащих язв
13. Мы рекомендуем терапию высокими дозами ИПП непрерывно или периодически в течение 3 дней после успешной эндоскопической гемостатической терапии кровоточащей язвы (сильная рекомендация, доказательства среднего и высокого качества).
Резюме доказательств.
Гипотеза, приводящая к применению высоких доз ИПП у пациентов с кровоточащими язвами, основанная на данных in vitro , заключается в том, что уменьшение внутрижелудочной кислоты способствует образованию и стабильности сгустка ( 88–90 ). Неизвестно, должен ли целевой внутрижелудочный pH быть около 7 ( 88,89 ) или достаточно ли ингибирования индуцированного пепсином лизиса сгустка при pH> 4–5 ( 89,90 ).
Мы выявили 7 РКИ с 8 рандомизированными сравнениями терапии высокими дозами ИПП (определяемыми как ≥80 мг в день в течение как минимум 3 дней) с плацебо (6 РКИ) ( 54,91–95 ) или отсутствием лечения (2 сравнения в 1 РКИ). ( 96 ) после успешной эндоскопической гемостатической терапии (см. Дополнительную таблицу 11.1, дополнительный цифровой контент, http://links.lww.com/AJG/B962 ). Четыре сравнения включали непрерывную внутривенную терапию ИПП с болюсом 80 мг с последующей инфузией 8 мг / час в течение 72 часов ( 54,91,95,96 ) и 4 включали прерывистую терапию ИПП: 40 мг два раза в день перорально ( 92,94 ) , 20 мг каждые 6 часов перорально ( 93 ) и болюс 80 мг, а затем 40 мг каждые 12 часов внутривенно ( 96). Семь сравнений были из Азии и 1 из Ирана ( 93 ). Эти высококачественные доказательства показали, что терапия ИПП значительно уменьшала дальнейшее кровотечение (ОР = 0,43, 0,33–0,56), смертность (ОР = 0,41, 0,22–0,79) и хирургическое вмешательство (ОР = 0,42, 0,25–0,71) по сравнению с плацебо / отсутствием лечения. . Анализ подгрупп не выявил доказательств разницы в лечебном эффекте между непрерывной и прерывистой терапией ИПП (тесты для различий в подгруппах P ≥ 0,90). Анализ чувствительности, ограниченный 4 исследованиями, не допускающими монотерапию адреналином в качестве эндоскопической гемостатической терапии ( 91,92,94,95 ), также выявил пользу при дальнейшем кровотечении: ОР = 0,35, 0,22–0,55.
Мы обнаружили 9 РКИ, в которых сравнивали терапию высокими дозами ИПП и терапией H2RA после успешной эндоскопической гемостатической терапии (см. Дополнительную таблицу 11.2, дополнительный цифровой контент, http://links.lww.com/AJG/B962 ). В четырех РКИ использовался внутривенный болюс 80 мг ИПП с последующей инфузией 8 мг / ч ( 97–100 ), в 1 применялся внутривенный болюс 40 мг ИПП с последующей инфузией 6,7 мг / ч ( 101 ) и в 4 применялась периодическая внутривенная терапия ИПП ( 40 мг каждые 6 часов ( 102 ) или каждые 12 часов ( 103 ); болюс 80 мг, затем 40 мг каждые 8 часов ( 104 ) или два раза в день ( 105 )). Шесть РКИ включали сайты в США ( 98 ) или Европе ( 99 100 102–104).). Эти доказательства среднего качества показали уменьшение дальнейшего кровотечения при применении ИПП по сравнению с терапией H2RA (ОР = 0,56, 0,41–0,77), но ни смертность, ни хирургическое вмешательство не были значительно ниже при применении ИПП. Опять же, не было отмечено различий в лечебном эффекте между непрерывной и прерывистой терапией ИПП (различия в подгруппах P > 0,90).
Мы идентифицировали 12 РКИ, в которых сравнивали болюс 80 мг с последующей непрерывной инфузией 8 мг / ч в течение 3 дней с менее интенсивным режимом ИПП после успешного эндоскопического гемостаза ( 96,106–116 ) (см. Дополнительную таблицу 11.3, дополнительный цифровой контент, http: // links.lww.com/AJG/B962 ). Сравнения были с дозой 40 мг / сут в 4 РКИ ( 106,108,109,112 ), 40 мг два раза в день в 3 РКИ ( 113–115 ), 80 мг два раза в день в 1 РКИ ( 107 ), болюсное введение 80 мг и 40-80 мг каждые 6 дней. –12 ч в 3 РКИ ( 96 110 111 ) и болюс 40 мг с последующей инфузией 4 мг / ч в 1 РКИ ( 116). Метааналитическая оценка дальнейшего кровотечения при непрерывной болюсной инфузии по сравнению с менее интенсивными режимами (RR = 1,12, 0,86–1,47; разница рисков = 1%, от −2% до 4%) имела тенденцию к большему, чем уменьшению дальнейшего кровотечения при болюсном введении. ИПП при непрерывной инфузии, хотя нижние границы 95% доверительного интервала соответствовали снижению относительного риска на 14% или снижению абсолютного риска на 2% при режиме непрерывной болюсной инфузии. Анализ подгрупп не показал существенных различий, связанных с дозой, частотой или способом введения ИПП.
Группа настоятельно рекомендовала назначать высокие дозы ИПП непрерывно или периодически в течение 3 дней после успешного эндоскопического гемостатического лечения, основываясь на высококачественных доказательствах, подтверждающих значительное снижение относительного риска дальнейшего кровотечения и смертности по сравнению с плацебо / отсутствием лечения и Доказательства среднего качества, подтверждающие преимущество дальнейшего кровотечения по сравнению с H2RA. Величина пользы в этих РКИ была практически идентична болюсной высокой дозе с последующей непрерывной инфузией ИПП (болюс 80 мг, инфузия 8 мг / ч) и прерывистой ИПП со средней общей суточной дозой 80–160 мг (некоторые с начальный болюс 80 мг).
Затем группа рассмотрела дозировку и способ применения высоких доз ИПП. Доказательства высокого качества подтверждают болюсное введение 80 мг с последующей инфузией 8 мг / ч у пациентов, получающих непрерывный режим высоких доз ИПП внутривенно. Напротив, имеющиеся данные не позволяют с уверенностью сказать об оптимальной дозировке прерывистой терапии высокими дозами ИПП. На основании РКИ предлагаются прерывистые дозы 40 мг 2-4 раза в день, вводимые перорально или внутривенно, при этом более высокие общие дозы потенциально желательны для западных популяций, поскольку, как сообщается, ИПП имеют меньший фармакодинамический и клинический эффект в западных странах, чем в странах Азии. популяции ( 117 ). Первоначальный пероральный или внутривенный болюс 80 мг может быть подходящим для потенциально большего воздействия на внутрижелудочный pH в первый день лечения ( 118). Прерывистые дозы можно вводить перорально, если пациент бодрствует, бодрствует и не испытывает тошноты, рвоты или дисфагии. Пероральное введение, по-видимому, дает фармакодинамический эффект, аналогичный эффекту эквивалентных доз внутривенного ИПП, хотя начальное повышение внутрижелудочного рН при пероральном приеме ИПП может отставать на 15-60 минут от внутривенного ИПП ( 111,119,120 ). На выбор непрерывной инфузии или прерывистой терапии ИПП могут влиять такие факторы, как простота введения и стоимость.
Заключение.
Терапия высокими дозами ИПП, определяемая как ≥80 мг в день в течение ≥3 дней, назначаемая постоянно или периодически после эндоскопической гемостатической терапии, снижает дальнейшее кровотечение и смертность. Непрерывная терапия должна включать болюс 80 мг с последующей инфузией 8 мг / ч. Напротив, оптимальная дозировка при прерывистой пероральной или внутривенной терапии не определена, хотя мы предлагаем болюс 80 мг с последующим приемом 40 мг 2–4 раза в день. Настоящая рекомендация расширяет рекомендацию Руководства ACG 2012 ( 1 ) за пределы ИПП для непрерывной инфузии и включает периодическое пероральное или внутривенное введение высоких доз ИПП. Предлагаемая эндоскопическая и медикаментозная терапия, основанная на эндоскопических характеристиках язв, показана на Рисунке 3 .
14. Мы предлагаем, чтобы пациенты с высоким риском UGIB из-за язвы, которые получали эндоскопическую гемостатическую терапию с последующей краткосрочной терапией высокими дозами ИПП в больнице, продолжали терапию ИПП два раза в день в течение 2 недель после индексной эндоскопии (условная рекомендация, низкая - доказательства качества).
Резюме доказательств.
Затем группа рассмотрела дозирование ИПП для пациентов из группы высокого риска, которые получали рекомендованную эндоскопическую гемостатическую терапию с последующей краткосрочной терапией высокими дозами ИПП. Было выявлено одно РКИ, в которое вошли пациенты с показателем Рокалла ≥6, прошедшие успешную эндоскопическую гемостатическую терапию по поводу язв с активным кровотечением, некровоточащих видимых сосудов или прилипшего сгустка и получивших 3 дня болюса с последующей непрерывной инфузией ИПП ( 121 ) (см. дополнительную таблицу 12.1, Дополнительный цифровой контент, http://links.lww.com/AJG/B962). Пациентам случайным образом назначали 40 мг эзомепразола перорально два раза в день против одного раза в день в течение 11 дней, а затем все пациенты получали еще 2 недели эзомепразола 40 мг один раз в день. Дальнейшее кровотечение было ниже как через 14 дней, так и при первичном анализе через 28 дней (10/93 [10,8%] против 27/94 [28,7%]; разница = -18%, от -29% до -7%). Группа сочла, что прием ИПП два раза в день в течение ~ 2 недель безопасен, хорошо переносится, легко доступен и относительно дешев. Эти факторы в сочетании с доказательствами низкого качества эффективности в снижении дальнейшего кровотечения привели группу к условной рекомендации по назначению ИПП два раза в день в течение 2 недель после индексной эндоскопии в этой популяции. Через 2 недели схема, использованная в единственном релевантном РКИ ( 121) перевели пациентов на двухнедельный курс приема ИПП один раз в сутки. Имеющиеся данные не позволяют нам определить, принесут ли более длительные курсы ИПП два раза в день или общую терапию ИПП дополнительную пользу в этой популяции.
Заключение.
Терапия ИПП два раза в день с 4 по 14 дни после индексной эндоскопии снижает дальнейшее кровотечение по сравнению с приемом ИПП один раз в день у пациентов из группы высокого риска, которые получали эндоскопическую терапию с последующими 3 днями терапии высокими дозами ИПП. Это новая рекомендация, основанная на данных, которые стали доступны после публикации Руководства ACG 2012 года.
Рецидивирующее кровотечение из язвы после успешной эндоскопической гемостатической терапии
15. Мы предлагаем пациентам с рецидивирующим кровотечением после эндоскопической терапии кровоточащей язвы пройти повторную эндоскопию и эндоскопическую терапию, а не подвергать хирургическому вмешательству или транскатетерной артериальной эмболизации (условная рекомендация, доказательства низкого качества для сравнения с хирургическим вмешательством, доказательства очень низкого качества для сравнение с транскатетерной эмболизацией артерий).
Резюме доказательств.
Одно РКИ оценивало повторную эндоскопию по сравнению с неотложной операцией у пациентов с повторным кровотечением после эндоскопической терапии ( 122 ) ( таблица 8 ; см. Дополнительную таблицу 13.1, дополнительный цифровой контент, http://links.lww.com/AJG/B962). Lau et al. обнаружили более частое дальнейшее кровотечение при эндоскопии по сравнению с хирургическим вмешательством (11/48 [22,9%] против 3/44 [6,8%]; разница = 16%, 2% –30%), но не было значительной разницы в смертности (5/48 [10,4%] ] против 8/44 [18,2%]; разница = -8%, от -23% до 7%). Впоследствии хирургическое вмешательство потребовалось в 13 из 48 (27,1%) назначенных для эндоскопии, в то время как вторая операция потребовалась в 4 из 44 (9,1%) назначенных для хирургического вмешательства (разница = 18%, 3% –33%). Осложнения при эндоскопии встречались реже (7/48 [14,6%] против 16/44 [36,4%]; разница = -22%, от -39% до -4%) и возникали после спасательной операции у всех, кроме 1 пациента при эндоскопии. группа. Продолжительность пребывания в больнице была одинаковой в двух группах.
Таблица 8.
Таблица 8 .: Рандомизированное исследование повторного эндоскопического лечения в сравнении с хирургическим вмешательством у пациентов с рецидивирующим кровотечением после успешной эндоскопической терапии ( 122 )
Учитывая, что повторное применение эндоскопической терапии было успешным в предотвращении дальнейшего кровотечения примерно у трех четвертей пациентов с рецидивирующим кровотечением из язвы после эндоскопической терапии и было связано с гораздо меньшим количеством осложнений, чем хирургическое лечение, группа предложила повторную эндоскопию, а не хирургическое лечение в это население. Нет РКИ, сравнивающих повторную эндоскопию с интервенционной радиологией с ТАЕ. Однако, учитывая относительно высокий уровень успешности повторной эндоскопической терапии рецидивирующего кровотечения после начальной эндоскопической терапии, о которой сообщили Lau et al. ( 122 ) и в упомянутом выше рандомизированном контролируемом исследовании клипов с дополнительным объемом работ ( 86), а также безопасность, простота и доступность эндоскопии, группа предложила повторную эндоскопию, а не TAE у этих пациентов, хотя доказательства считались очень низким качеством.
Следует соблюдать осторожность при проведении повторной эндоскопической терапии. У двух из 48 пациентов, получавших повторную терапию нагревательным датчиком в РКИ ( 122 ), развилась перфорация, и метаанализ побочных эффектов в РКИ эндоскопической терапии показал, что примерно половина перфораций, о которых сообщалось с нагревательным датчиком, произошла у пациентов, получавших 2 последовательных лечения ( 33). Хотя доказательства неконтролируемы и очень низкого качества, эти отчеты повышают вероятность того, что термоконтактная терапия, такая как нагревательный зонд, при проведении последовательных эндоскопий во время одной и той же госпитализации может иметь повышенный риск перфорации. Таким образом, можно рассмотреть альтернативные формы гемостатической терапии, если при первичной эндоскопии использовался тепловой контакт. Кроме того, случайным пациентам может быть предложено лечение ТАЕ или хирургическое вмешательство, а не повторная эндоскопия на основании клинических или эндоскопических особенностей. Например, в рандомизированном исследовании Lau et al. ( 122 ), неэффективность повторной эндоскопической гемостатической терапии была связана с гипотензией во время повторного кровотечения и размером язвы> 2 см.
Заключение.
У пациентов с рецидивирующим кровотечением после эндоскопической терапии кровоточащей язвы повторная эндоскопия и эндоскопическая терапия успешно предотвращают дальнейшее кровотечение примерно у трех четвертей пациентов с меньшим количеством осложнений, чем хирургическое лечение. Эта рекомендация не изменилась по сравнению с Руководством АЧГ 2012 г. ( 1 ).
Неэффективность эндоскопической гемостатической терапии кровоточащих язв
16. Мы предлагаем пациентам с кровоточащими язвами, которые не прошли эндоскопическую терапию, в следующий раз провести транскатетерную артериальную эмболизацию (условная рекомендация, доказательства очень низкого качества).
Резюме доказательств.
Неудача эндоскопической терапии может иметь разные определения; например, стойкое кровотечение после начальной или последующей эндоскопической терапии и рецидивирующее кровотечение после повторной эндоскопической терапии. Систематический обзор и метаанализ 13 обсервационных исследований неварикно-сосудистой хирургии (все с высоким риском систематической ошибки) ( 123 ) и последующее популяционное когортное исследование всех пациентов с кровотечением из язвенной болезни, которым не удалось эндоскопическая терапия, в Стокгольме с 2000 г. по 2014 г. ( 124 ) соответствовали критериям оценки TAE по сравнению с хирургическим вмешательством (см. дополнительную таблицу 14.1, дополнительный цифровой контент, http://links.lww.com/AJG/B962). Результаты метаанализа и дополнительного когортного исследования были схожими без различия в смертности, зарегистрированной для TAE и хирургического вмешательства: OR = 0,77, 0,50–1,18 в метаанализе ( 123 ); в когортном исследовании скорректированная 30-дневная смертность HR = 0,70, 0,37–1,35 ( 124 ). Дальнейшее кровотечение чаще встречалось при ТАЕ по сравнению с хирургическим вмешательством (OR = 2,44, 1,77–3,36 в метаанализе; скорректированный HR в когортном исследовании = 2,48, 1,33–4,62), тогда как серьезные осложнения были менее распространены при TAE (OR = 0,45, 0,30 в метаанализе). –0,67; когортное исследование: 9/109 [8,3%] против 66/205 [32,2%], разница = -24%, от -32% до -16%). Пребывание в больнице было короче с TAE в когортном исследовании: в среднем 8 против 16 дней; скорректированный коэффициент ускорения = 0,59, 0,45–0,77.
Хотя хирургическое вмешательство, вероятно, было более эффективным в сокращении дальнейшего кровотечения, тот факт, что TAE был связан со значительно меньшим количеством осложнений и не был связан с увеличением смертности, заставил группу экспертов предположить, что TAE был разумным первоначальным выбором для лечения пациентов с кровоточащими язвами, у которых не удалось эндоскопически терапия. Тем не менее, выбор между TAE и хирургическим вмешательством может варьироваться в зависимости от таких факторов, как сопутствующие заболевания пациента и текущий медицинский статус, а также от местного опыта и доступности процедур (например, опыт местных интервенционных радиологов в TAE для UGIB и опыт местных хирургов в хирургии язв. ). Более того,
Заключение.
У пациентов, которым не удалось провести эндоскопическую терапию, TAE показывает заметное сокращение осложнений и продолжительности пребывания в больнице без разницы в смертности по сравнению с хирургическим вмешательством, но имеет более высокую скорость дальнейшего кровотечения. Новые данные привели к изменению Руководства ACG 2012 г., в котором говорилось, что обычно используется хирургическое вмешательство или TAE ( 1 ).
БУДУЩИЕ НАПРАВЛЕНИЯ
Большая часть доказательств, подтверждающих эти положения рекомендаций, имеет низкое или очень низкое качество, что позволяет предположить, что существует множество возможностей для дальнейшего исследования, чтобы улучшить ведение пациентов с UGIB. Темы для изучения в будущем могут включать следующие. (i) Повышение эффективности инструментов оценки рисков и внедрение электронных медицинских карт для своевременной поддержки принятия решений. Дальнейшие исследования должны быть направлены на повышение специфичности выявления пациентов с очень низким риском, улучшение показателей при выявлении пациентов с высоким риском (например, тех, кому может потребоваться переливание крови, гемостатическое вмешательство или интенсивная терапия), а также документальное подтверждение того, что внедрение может улучшить результаты. (ii) Улучшение начального предэндоскопического ведения.Остается неопределенность относительно начальной реанимации: должно ли быть целью нормальный уровень артериального давления или целесообразно более ограниченное введение жидкости и более низкие целевые значения артериального давления, по крайней мере, в подгруппе пациентов с более сильным кровотечением? Аналогичным образом, существуют ли критерии (например, гемодинамический статус и реакция на первоначальную реанимацию), которые определяют подгруппу пациентов, которым будет полезна очень ранняя эндоскопия? Хотя преэндоскопические ИПП широко используются с заметной вариабельностью в рекомендациях, исследование, должным образом разработанное для выявления любой потенциальной небольшой клинической пользы, не показанной ранее, будет большим и сложным. (iii) Усовершенствования гемостатической терапии. Области исследования включают определение того, требуют ли язвы, обработанные гемостатическим порошковым спреем, эндоскопического лечения с использованием второго метода - по крайней мере, в отдельных случаях (например, брызги), более точное определение ситуаций для использования различных методов (например, зажимы для увеличения объема), надлежащая оценка новых гемостатических вмешательств, роли допплеровского зонда в руководстве эндоскопической терапией и разработка экономических моделей, которые помогут выбрать терапию среди множества эффективных методов.
КОНФЛИКТ ИНТЕРЕСОВ
Гарант статьи: Loren Laine, MD.
Конкретный вклад авторов: LL: концепция и дизайн исследования; литературный обзор; извлечение данных; анализ и интерпретация данных; и первоначальное редактирование рукописи. ANB и JRS: концепция и дизайн исследования; литературный обзор; извлечение данных; интерпретация данных; и критический пересмотр рукописи. ММ: обзор литературы; извлечение данных; анализ и интерпретация данных; и критический пересмотр рукописи. GIL: концепция и дизайн кабинета; литературный обзор; извлечение данных; анализ и интерпретация данных; и критический пересмотр рукописи. Все авторы одобрили представленный окончательный проект.
Финансовая поддержка: Американский колледж гастроэнтерологии (поддержка поиска литературы).
Возможные конкурирующие интересы: LL: консультант, Phathom Pharmaceuticals. ANB: консультант / член консультативного совета, Olympus; консультант / спикер, повар. JRS, MM и GIL: не о чем сообщать.
БЛАГОДАРНОСТИ
Это руководство было разработано в сотрудничестве с Комитетом по параметрам практики Американского колледжа гастроэнтерологии. Комитет выражает особую благодарность Нилу Сенгупте, доктору медицины, FACG, который выполнял функции мониторинга этого документа..
- Статьи: Новые рекомендации Американского колледжа гастроэнтерологии (ACG) по кровотечениям из верхних отделов желудочно-кишечного тракта и из язвенных кровотечений 2021
- Видеозапись. Кровотечения верхнего отдела ЖКТ: Лечебно-диагностические алгоритмы
- Ведение невариксного кровотечения из верхних отделов желудочно-кишечного тракта: руководящие рекомендации Международной консенсусной группы 2019 (Перевод последнего гайдлайна по кровотечениям)
- Статьи: Кавернозная гемангиома тощей кишки как источник рецидивирующего кишечного кровотечения у ребёнка 11 лет
- Статьи: Протоколы организации лечебно-диагностической помощи при неварикозных желудочно-кишечных кровотечениях (из хронических язв желудка, двенадцатиперстной кишки и пептических язв ГЭА – МКБ-10-К25.4, К26.4, К28.4)
- Видеозапись Кровотечения нижнего отдела ЖКТ: Лечебно-диагностические алгоритмы
Рекомендуемые статьи
Синдром Аддисона - Бирмера
(злокачественное малокровие, пернициозная анемия, в12-дефицитная анемия) B12 анемия, обусловленная аутоимунными механизмами, сопровождается ахилией, отсутствие пепсина и продукцией антител к париетальным клеткам.Гастроскопия выявляет гнездную, реже тотальную атрофию слизистой желудкаХарактерным симптомом является наличие так называемых перламутровых бляшек — блестящих зеркальных участков атрофии слизистой, локализующихся главным образом на складках слизистой желудка.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.











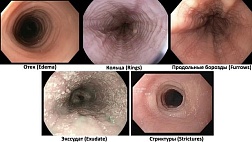




.jpg)




.png)















Комментарии