- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Обновленные 2021 Глобальные рекомендации Всемирной гастроэнтерологической организации по Хеликобактер пилори. Практическое руководство WGO - Helicobacter Pylori
| Авторы: | Peter Katelaris (Co-Chair, Australia), Richard Hunt (Co-Chair, United Kingdom), Franco Bazzoli (Italy), Henry Cohen (Uruguay), Kwong Ming Fock (Singapore), Manik Gemilyan (Armenia), Peter Malfertheiner (Germany), Francis Mégraud (France), Alejandro Piscoya (Peru), Duc Quach (Vietnam), Nimish Vakil (USA), Louis G. Vaz Coelho (Brazil), Anton LeMair (Netherlands) 1 2021г. |
| Об авторах: |
1. Review team World Gastroenterology Organisation Global Guidelines |
Полный текст статьи:
1
Вступление
Helicobacter pylori был признан основным патогеном человечества на протяжении почти четырех десятилетий. Однако, несмотря на воздействие лечения инфицированных людей и сокращение передачи инфекции в сообществах, в которых повысился социально-экономический уровень жизни, он продолжает оставаться наиболее распространенным бактериальным патогеном человека, заражая, возможно, половину населения мира. В результате он по-прежнему остается основной причиной заболеваемости и смертности во всем мире.
Бремя болезней непропорционально ложится на менее обеспеченные ресурсы населения. Как и в случае с большинством инфекционных заболеваний, наибольшее влияние на снижение этого бремени оказывает улучшение социально-экономического статуса, которое прерывает передачу. Это наблюдается во многих регионах мира, но распространенность инфекции остается высокой во многих регионах, в которых повышение уровня жизни происходит медленно.
Между тем, оптимальные клинические методы ведения и лечения остаются нерешенными и развиваются с изменением моделей устойчивости к противомикробным препаратам. Несмотря на десятилетия исследований и клинической практики, серьезные проблемы остаются. Поиск наиболее эффективных, безопасных и простых методов лечения по-прежнему остается серьезной проблемой для врачей. Эффективная вакцина также все еще остается труднодостижимой.
Клинические руководства нередко содержат противоречивые советы. Руководствам очень сложно достичь актуальности для различных групп населения с различным спектром заболеваний, уровнями устойчивости к противомикробным препаратам и сильно различающимися ресурсами. Поскольку местные факторы имеют решающее значение для определения воздействия и стратегий борьбы с инфекцией H. pylori , важно, чтобы пути распространения инфекции основывались на наилучших имеющихся местных знаниях, а не экстраполировались исключительно на основе рекомендаций, сформулированных в других регионах, которые могут быть менее применимы. С этой целью данная редакция WGO H. pylori В руководстве используется «каскадный» подход, который стремится обобщить принципы управления и предложить рекомендации по прагматическим, актуальным и достижимым путям диагностики и лечения, основанным на установленных ключевых принципах лечения и использовании местных знаний и имеющихся ресурсов для руководства региональной практикой.
Helicobacter pylori был признан основным патогеном человечества на протяжении почти четырех десятилетий. Однако, несмотря на воздействие лечения инфицированных людей и снижение передачи инфекции в сообществах, в которых улучшился социально-экономический уровень жизни, он продолжает оставаться наиболее распространенным бактериальным патогеном человека, заражая, возможно, половину населения мира [ 1 ]. В результате он по-прежнему остается основной причиной заболеваемости и смертности во всем мире.
Инфекция H. pylori неизменно вызывает активный хронический гастрит. У большинства людей это может быть клинически незаметным на протяжении всей жизни, но в значительном меньшинстве это вызывает гастродуоденальные заболевания, в первую очередь язвенную болезнь, некардиальный рак желудка и лимфому, ассоциированную со слизистой оболочкой желудка (MALT). Он также увеличивает риск гастродуоденальной язвы и кровотечения у пациентов, принимающих нестероидные противовоспалительные препараты (НПВП), такие как аспирин, и вызывает симптомы у некоторых пациентов с функциональной диспепсией.
H. pylori интенсивно изучается. Литературный поиск выявил более 45 000 публикаций. Многое было изучено об эпидемиологии инфекции, биологии, генетике, патофизиологии, выражении болезни, диагностике и лечении. Однако в наших знаниях остаются серьезные пробелы. Точный способ передачи инфекции остается неясным, несмотря на многочисленные эпидемиологические исследования, которые определяют факторы риска заражения. Детерминанты проявления болезни все еще не полностью изучены, включая многие аспекты взаимодействия хозяин-патоген. Патофизиология этого взаимодействия сложна и подробно рассмотрена в других работах [ 2 , 3]. Оптимальные пути клинического ведения в различных условиях все еще остаются предметом дискуссий, и продолжается поиск усовершенствований в диагностических методах. Поиск наиболее эффективных, безопасных и простых методов лечения по-прежнему является серьезной проблемой для клиницистов, а проблема устойчивости к противомикробным препаратам остается серьезной проблемой. Лучший метод наблюдения за неблагоприятными гистологическими изменениями слизистой оболочки желудка не определен, и поиск эффективной вакцины продолжается.
Там было много обзоров и клинических руководств по H. пилори [ 4 - 12 ]. Поскольку эта область быстро меняется, существует потребность в периодическом обновлении и пересмотре этих позиционных документов. Кроме того, руководящим принципам очень сложно добиться соответствия широкому кругу групп населения с различным спектром заболеваний и часто с совершенно разными ресурсами для борьбы с ними. Руководящие принципы нередко содержат противоречивые советы. Поскольку местные факторы имеют решающее значение для определения воздействия и стратегии борьбы с H. pyloriзараза, это неудивительно. Важно, чтобы клинические рекомендации основывались на наилучших доступных местных данных, а не экстраполировались на рекомендации, сформулированные в других регионах, которые могут быть менее применимы. Однако во многих областях, в которых влияние инфекции H. pylori наиболее велико, отсутствуют качественные данные для определения наилучшей местной практики. Устранение этого пробела в знаниях - серьезная задача. Между тем, решения должны основываться на наилучших доступных местных доказательствах, экстраполяции более качественных данных из других источников и мнении экспертов.
Целью этого обновления руководства WGO является обобщение и обзор доказательств из ряда новых руководств, в которых описывается передовой опыт, и предложение того, как эти принципы могут быть применены во всем мире с использованием «каскадного» подхода. Этот подход учитывает различия в региональной распространенности и влиянии инфекции, а также огромные различия в ресурсах здравоохранения, доступных для решения проблемы, что требует прагматических, адаптированных к местным условиям подходов. Бремя болезней, вызываемых H. pylori, непропорционально ложится на менее обеспеченные ресурсами регионы, которые недостаточно представлены в эпидемиологических исследованиях и часто не являются предметом клинических рекомендаций.
Ключевое утверждение Важной
задачей для руководящих принципов является достижение актуальности для самых разных групп населения с различным спектром заболеваний и с совершенно разными ресурсами для борьбы с ними.
3.1 Естественная история инфекции
Инфекция H. pylori обычно сохраняется на всю жизнь, если ее не лечить антибиотиками или аутоэрадикация возникает, когда длительная инфекция вызывает широко распространенную атрофию слизистой оболочки желудка и метаплазию с ахлоргидрией. У некоторых младенцев может развиться транзиторная инфекция. Реинфекция после лечения у взрослых редко встречается как в регионах с высокой, так и с низкой распространенностью. Реинфекцию можно спутать с реинфекцией, когда инфекция временно подавляется, ниже порога обнаружения с помощью тестов, но не устраняется антибиотиками. Во всем мире существуют различия в вирулентности различных штаммов H. pylori. Взаимодействие между хозяином и факторами окружающей среды может привести к различиям в выражении болезни.
3.2 Передача инфекции
Хотя существуют хорошо описанные факторы риска инфицирования и правдоподобные гипотезы, точный способ передачи окончательно не установлен. Большинство случаев заражения происходит в раннем детстве, а меньшая часть случаев - у взрослых. Имеются убедительные данные эпидемиологических и генетических исследований передачи инфекции от человека к человеку, особенно в семьях. Матери оказываются особенно важными в передаче их маленьким детям. Наиболее вероятным представляется попадание в организм через желудочно-оральный или орально-оральный путь. Фекально-оральная передача менее вероятна, по крайней мере, в развитых странах. Вопрос о том, происходит ли передача через воду, пищу, домашних животных или мух, все еще остается предметом предположений.
3.3 Эпидемиология
Хотя считается, что половина населения мира инфицирована H. pylori, распространенность инфекции широко варьируется между странами и внутри стран (рис. 1). Кроме того, распространенность может варьироваться в пределах одного города, а также между подгруппами населения (рис. 2) [13]. Например, могут быть большие различия в распространенности инфекции между более обеспеченным городским и сельским населением.
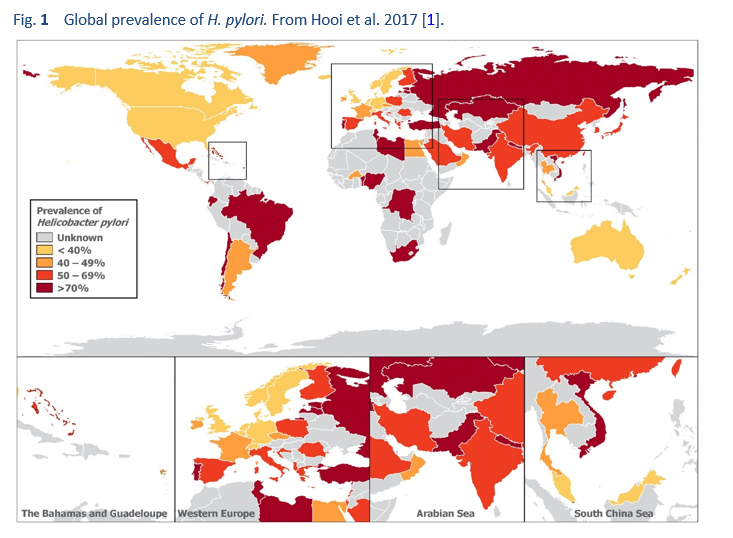
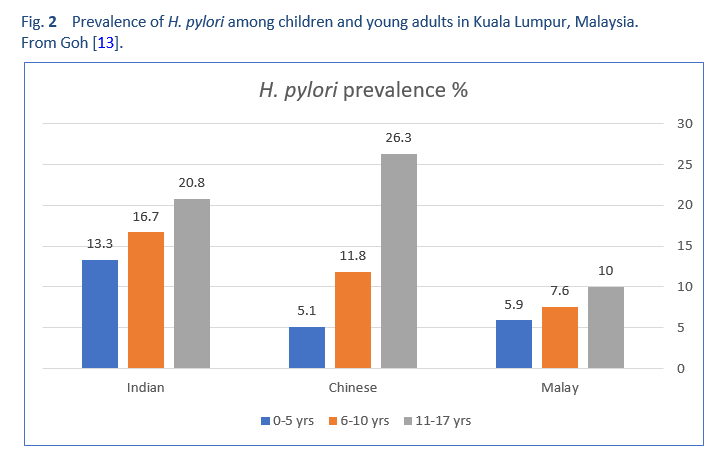
Качество данных о распространенности варьируется. Многие исследования не являются истинными исследованиями распространенности, а скорее являются аудитами клинических подгрупп. Другие исследования могут не отражать достоверный поперечный разрез населения. Кроме того, качество отчетов сильно различается. В некоторых регионах диагностические методы могут быть менее надежными, в то время как в некоторых странах они представлены плохо, поскольку у них вообще отсутствуют какие-либо надежные данные. По всем этим причинам нельзя использовать одну цифру для суммирования и представления распространенности инфекции во всей стране, и ее следует применять с осторожностью. Например, исследование распространенности в одном городе в одном регионе густонаселенной многонациональной страны с большими различиями в социально-экономических стандартах вряд ли представит истинную распространенность по всей стране и не может отразить подгруппы высокого и низкого риска. Однако,
Основным фактором, определяющим распространенность инфекции, является социально-экономический статус в детстве. Социально-экономические факторы отражают уровень гигиены, санитарии, плотность проживания и уровень образования.
Постоянно сообщалось о сильной обратной зависимости. Таким образом, как и ожидалось, распространенность инфекции, как правило, выше в развивающихся странах, и инфекция почти повсеместна в некоторых из наиболее бедных ресурсами подгрупп этих групп населения. Мигранты из таких регионов считаются группой высокого риска в более развитых странах с низкой распространенностью.
Ключевое утверждение
Основным фактором, определяющим распространенность инфекции, является социально-экономический статус в детстве.
Распространенность инфекции H. pylori увеличивается с возрастом. В основном это связано с когортным эффектом, при котором риск заражения инфекцией был выше в детстве у тех, кто родился более давно, по сравнению с более недавним, а не отражением продолжающегося заражения взрослыми. Этническая принадлежность была описана как фактор риска, но, скорее всего, она тесно связана с социально-экономическим статусом или практиками, которые могут увеличить риск передачи, а не с генетической основой.
Поразительным наблюдением стало изменение распространенности инфекции с течением времени в некоторых странах. Сообщения о быстром снижении показателей инфицирования, особенно среди детей и молодых людей, распространены из развитых стран и из стран, которые пережили быстрое экономическое развитие, которое привело к повышению социально-экономических стандартов. В этих странах распространенность инфекции сейчас низкая.
Это наблюдение предсказывает постепенное снижение распространенности язвенной болезни и некардиального рака желудка, поскольку в целом распространенность язвенной болезни и рака желудка отражает распространенность H. pylori в популяции. Действительно, распространенность язвенной болезни и рака желудка в развитых странах десятилетиями снижается. Падение заболеваемости отстает от снижения заболеваемости на многие годы. Снижение распространенности инфекций и болезней произошло задолго до того, как было обнаружено H. pylori и были разработаны методы лечения.
Как и в случае с большинством эндемических инфекционных заболеваний, снижение распространенности связано больше с улучшением гигиены и санитарии населения, чем с индивидуальным лечением в каждом конкретном случае, поскольку в большинстве стран только меньшинство инфицированных людей когда-либо будет получать терапию. Заметным исключением являются хорошо обеспеченные ресурсами страны с высокой распространенностью, такие как Япония, где скрининг и лечение в настоящее время систематически проводятся в раннем взрослом возрасте. Распространенность инфекции кажется стабильной в странах, в которых стандарты не улучшились или ухудшились, и вряд ли существенно снизится, пока не произойдет улучшение. Язвенная болезнь все еще широко распространена во многих из этих стран. Бремя рака желудка также непропорционально ложится на эти группы населения.
Ключевое утверждение
Как и в случае с большинством эндемических инфекционных заболеваний, снижение распространенности больше связано с улучшением гигиены и санитарии населения, чем с индивидуальным лечением в каждом конкретном случае, поскольку в большинстве стран только меньшая часть инфицированных людей когда-либо будет получать терапию.
4.1 H. pylori и язвенная болезнь
Признание того, что H. pylori является причиной большинства язв двенадцатиперстной кишки и около двух третей язв желудка, стало важным прорывом в медицине, получившим Нобелевскую премию [14]. Во многих развитых странах, где частота инфекций и излечение пациентов с язвой снижается, доля всех пептических язв, вызванных H. pylori , снижается. В менее развитых странах, где распространенность инфекции остается высокой и меньшее количество больных язвой получают лечебное лечение, язвенная болезнь (ЯБ) продолжает оставаться очень распространенным и важным заболеванием. Хеликобактер пилориСогласно оценкам, риск развития язвенной болезни у человека в течение жизни составляет 15–20%. Без лечения ЯБ является хроническим рецидивирующим и ремиттирующим заболеванием, которое вызывает большую смертность и заболеваемость из-за боли, кровотечения и перфорации. Это также приводит к экономическим потерям. Ликвидация H. pylori излечивает наиболее активные пептические язвы и предотвращает дальнейшие рецидивы, что приводит к излечению. Ликвидация H. pylori у пациентов с язвенной болезнью в анамнезе предотвращает последующие рецидивы.
НПВП и аспирин вызывают большинство других пептических язв. Хеликобактер пилори и НПВП действуют синергетически, повышая риск язв и кровотечений. Ликвидация H. pylori снижает этот риск до начала хронической терапии НПВП.
4.2 H. pylori, рак желудка и лимфома MALT
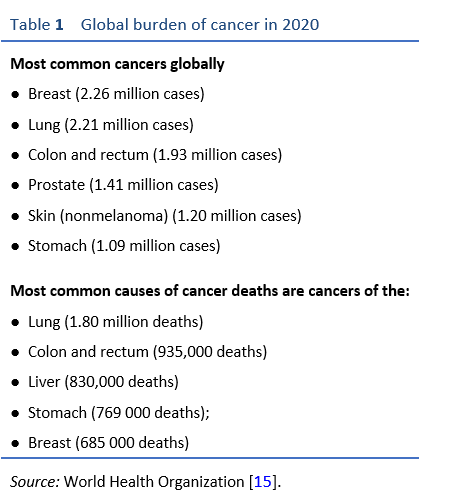
У восприимчивых инфицированных хозяев длительный активный хронический гастрит может привести к атрофии слизистой оболочки желудка с кишечной метаплазией. В меньшинстве эти предраковые изменения слизистой оболочки прогрессируют до дисплазии и клинически бессимптомного раннего рака, за которым следует прогрессирующий рак желудка. Рак желудка часто проявляется на запущенной, симптоматической стадии и, как правило, имеет неблагоприятный прогноз. Хеликобактер пилорипо оценкам, индивидуальный риск рака желудка на протяжении всей жизни у инфицированных людей составляет 1,5–2,0%. Несмотря на относительно низкий индивидуальный риск, поскольку глобальное число инфицированных оценивается в миллиарды, существует глобальное бремя рака желудка, превышающее один миллион в год, с высоким уровнем смертности (Таблица 1) [15]. Это бремя распределяется неравномерно. Восточная Азия - Япония, Корея и восточный Китай - имеют самую высокую распространенность болезни. В Китае страдает 40% случаев рака желудка в мире. Большинство, но не все, рака желудка связаны с H. pylori. Риск прогрессирования рака желудка варьируется и зависит от факторов хозяина и патогенов. Кофакторы хозяина включают курение и диету. Высокое потребление соли, маринованных продуктов и диета с низким содержанием антиоксидантов - это диетические кофакторы. Генетические факторы риска у хозяина, которые связаны с повышенным риском, включают наличие полиморфизмов в генах, которые определяют экспрессию интерлейкина-1 (IL-1; провоспалительные цитокины) и рецепторов распознавания патогенов. Генотипирование штаммовH. pylori выявила различия в факторах вирулентности, которые способствуют воспалению и связаны с повышенным риском рака.
Было показано, что искоренение H. pylori до появления неблагоприятных предраковых гистологических изменений предотвращает рак желудка и является обоснованием для программ массового обследования и лечения молодых людей в странах с высоким бременем болезни и с достаточными ресурсами для посвятить этому стремлению. В регионах с менее обеспеченными ресурсами и высоким бременем рака желудка такая стратегия остается желательной, а не осуществимой, учитывая ограниченные затраты, материально-технические трудности и конкурирующие потребности в области здравоохранения.
Искоренение H. pylori после развития атрофии слизистой оболочки и / или кишечной метаплазии может снизить риск рака желудка, но не устраняет его [ 16 ]. У любого человека остаточный риск связан со степенью и серьезностью изменений слизистой оболочки, а также с другими факторами риска для хозяина. В некоторых случаях целесообразно эндоскопическое наблюдение кишечной метаплазии.
Лимфоидная лимфома, связанная со слизистой оболочкой желудка (MALT), встречается редко. Большинство случаев являются следствием инфекции H. pylori , и ликвидация H. pylori, когда лимфома находится на стадии низкой степени злокачественности, приводит к регрессу и излечению. Иногда сообщалось о поздних рецидивах после эрадикации.
Ключевое утверждение Было показано, что
эрадикация H. pylori до возникновения неблагоприятных предраковых гистологических изменений предотвращает рак желудка и является обоснованием для программ массового обследования молодых людей в странах с высоким бременем болезни и достаточным количеством лекарств. ресурсы, которые нужно направить на это дело.
4.3 Диспепсия, связанная с H. pylori
В большинстве случаев гастрит, вызванный H. pylori, протекает бессимптомно, но обычно сопровождается симптомами верхних отделов кишечника при отсутствии язвенной болезни. Однако только около одной трети или менее инфицированных пациентов с «функциональной диспепсией» испытывают стойкое облегчение симптомов после эрадикационной терапии. Это связано с тем, что функциональная диспепсия - неоднородное состояние, которое может быть вызвано разными механизмами. Хеликобактер пилориможет быть причиной у одних пациентов с симптомами и случайно присутствовать у других. Однако доля инфицированных пациентов, у которых улучшилось состояние после эрадикационной терапии, больше, чем у тех, кто получает эмпирическую кислотосупрессивную терапию. Кроме того, пациенты могут получить пользу от снижения риска язвенной болезни и рака в течение жизни, особенно если они проходят лечение до того, как в слизистой оболочке желудка разовьются неблагоприятные гистологические изменения.
Недавно пересмотренная классификация гастрита признала диспепсию, ассоциированную с H. pylori, в качестве отдельной сущности, и она была включена в 11-ю редакцию Международной классификации болезней (МКБ-11) [ 11 ]. Классификация также подчеркивает значение гастрита, вызванного H. pylori, как предшественника поражения, которое приводит к язвенной болезни и раку желудка, независимо от наличия симптомов.
Инфекция H. pylori связана с множеством других состояний. В большинстве случаев причинно-следственная связь не доказана, и у некоторых пациентов неизбежно сосуществуют общие состояния. Имеются скромные данные о связи H. pylori с иммунной тромбоцитопенической пурпурой, и была опробована эрадикационная терапия с разными результатами.
5.1 Кого тестировать и лечить?
Решение о том, лечить или не лечить H. pylori, должно быть активным, с учетом обстоятельств и рисков конкретного пациента. Поэтому решение о тестировании на H. pylori следует принимать только с терапевтической целью.
Рекомендации по передовой практике
Решение о тестировании на H. pylori должно приниматься только с терапевтической целью.
Доказательные показания для тестирования и лечения H. pylori представлены в таблице 2 [ 4 , 17 ]. Применимость каждого показания в разных регионах будет зависеть от распространенности инфекции и заболевания, ресурсов, конкурирующих потребностей и индивидуальных факторов пациента. Язвенная болезнь - это главное показание в большинстве стран мира. Клинические и медицинские и экономические преимущества краткосрочной лечебной терапии распространенного хронического серьезного заболевания были наглядно продемонстрированы на протяжении многих лет. В регионах с ограниченными ресурсами это показание к терапии должно быть приоритетным.

6.1 Эндоскопические диагностические тесты
Диагностические тесты на H. pyloriИнфекция может быть инвазивной (эндоскопической) или неинвазивной (неэндоскопической) (Таблица 3). Биопсии, взятые при эндоскопии, чаще всего используются для гистологического анализа и исследования уреазы. Биопсии для посева реже используются для диагностики, за исключением случаев, когда тест на устойчивость к противомикробным препаратам доступен и необходим для оказания помощи в принятии индивидуальных клинических решений или определения уровней устойчивости населения. Комбинация двух методов тестирования, взятых из двух топографических точек желудка, как правило, наиболее эффективна для диагностики. На практике это обычно означает биопсию, взятую из антрального отдела и тела желудка для гистологии и из антрального отдела для анализа на уреазу. Более структурированные протоколы биопсии могут использоваться, когда есть дополнительная необходимость в гистологическом наблюдении.18 ]. Гистология обычно дорогостоящая и очень зависит от оператора, и нельзя предполагать точность, кроме как по сравнению с другими предыдущими методами тестирования.
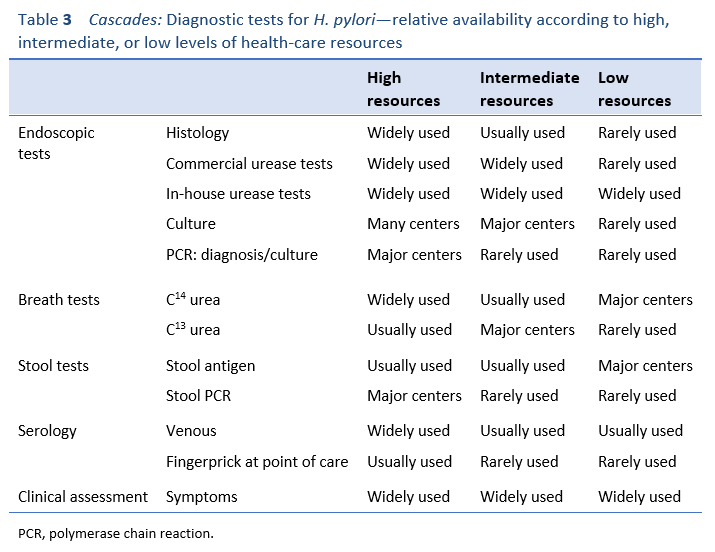
В регионах с ограниченными ресурсами обычно полагаются на тесты на уреазу. Большинство коммерческих тестов на уреазу имеют точность около 95%. Хотя они намного дешевле, чем гистологические, эти тесты все же могут повлечь за собой значительное бремя затрат в регионах с ограниченными ресурсами, особенно когда их несет пациент. Коммерческий тест обычно стоит 5 долларов США. В регионах, где средний дневной доход неквалифицированного рабочего может составлять 1-2 доллара США, это может быть недоступно. К счастью, существуют очень недорогие тесты на генерическую уреазу, которые доступны в течение многих лет и могут быть выполнены на месте по цене около 0,20 доллара за единицу. Обычно это небуферизованные тесты, которые дают очень быстрый результат и имеют чувствительность, очень похожую на чувствительность коммерческих тестов [ 19]. Они используются в некоторых странах Африки, Азии и Тихоокеанского региона.
Выращивание H. pylori из биопсий требует особых условий транспортировки, лабораторных навыков и оборудования. Показатели успеха в культуре могут достигать 90% в экспертных центрах, но часто ниже, чем в менее экспертных центрах. Субкультивирование для тестирования на противомикробные препараты также не всегда может быть успешным в менее опытных лабораториях, поэтому результаты не всегда могут быть получены при необходимости. Есть теперь коммерчески доступны в режиме реального времени полимеразной цепной реакции (ПЦР) тесты , которые позволяют обнаруживать H. пилори с высоким уровнем чувствительности и специфичности, а также мутаций , что сопротивление причиной кларитромицин [ 20 - 22]. Эти тесты не требуют строгих преаналитических условий и могут быть выполнены за несколько часов. Утверждение и внедрение этих быстрых и недорогих тестов на устойчивость к противомикробным препаратам в местах оказания медицинской помощи обещает стать крупным достижением в управлении. Доступность таких тестов в регионах с высокой резистентностью может значительно помочь в выборе терапии для отдельных пациентов, а также облегчить обследования распространенности среди населения.
Рекомендации по передовой практике
Валидация и внедрение быстрых, недорогих диагностических ПЦР на основе наборов и тестов на устойчивость к противомикробным препаратам обещает стать крупным достижением в управлении.
Эндоскопическая диагностика язвенной болезни двенадцатиперстной кишки в регионе с более высокой распространенностью, с ограниченными ресурсами у пациента, не принимающего НПВП, имеет точность 95% для прогнозирования наличия H. pylori . Хотя для подтверждения инфекции желателен тест на основе биопсии, наличие язвы двенадцатиперстной кишки имеет прогностическую ценность, аналогичную значению большинства тестов, и поэтому разумно лечить без дополнительных затрат (если не доступны недорогие общие тесты на уреазу).
6.2 Неинвазивные диагностические тесты
Когда эндоскопия не требуется или недоступна, можно использовать неинвазивные тесты. Дыхательные тесты на мочевину (UBT) очень полезны и имеют более высокую диагностическую точность, чем другие неинвазивные тесты для выявления H. pylori (у пациентов без гастрэктомии в анамнезе). Несколько удивительно, что они не так широко доступны во многих странах, в которых H. pyloriи язвенная болезнь. Причины этого сложны и могут включать нехватку опыта или ресурсов для создания и эксплуатации лабораторий анализа дыхания, относительно высокую стоимость коммерческих наборов тестов или чрезмерную зависимость от эмпирической терапии или эндоскопии. Во многих случаях серьезное беспокойство по поводу рака желудка является основным фактором использования эндоскопии (хотя, когда они становятся симптоматическими, рак желудка редко излечивается). Стоимость UBT варьируется. В странах с более высокими ресурсами затраты очень выгодны по сравнению с эндоскопией, хотя в регионах, в которых эндоскопия является относительно недорогой, преимущество в стоимости исчезает, если не будут доступны недорогие UBT. Стабильный изотоп C 13Тест UBT прошел детальную валидацию во многих местах, и его часто предпочитают в регионах с хорошими ресурсами. C 14 UBT использует очень низкую дозу радиоактивного изотопа и, как правило, имеет более короткое время сбора, но не получил столь широкой валидации. Это может быть несколько менее точным. Стоимость лабораторной установки для УБТ C 13 выше, поскольку требуется масс-спектрометр, тогда как для УБТ C 14 необходим менее дорогой сцинтилляционный счетчик . Реальная (а не коммерческая) стоимость единицы C 14изотопа является низким, поэтому тест может быть проведен по очень низкой цене с использованием центральной лабораторной модели «концентратор и спица» для оказания услуг, при этом образцы дыхания, собранные удаленно, доставляются со всего региона. Доступны коммерческие комплекты и анализаторы для пунктов оказания медицинской помощи. Точность варьируется, и стоимость единицы этих наборов часто бывает высокой.
Другой вариант - исследование стула на антиген. Эти тесты кажутся почти такими же точными, как и UBT, но пациенты, медицинские и лабораторные работники часто меньше отдают предпочтение тестам на основе стула. Стоимость является проблемой в некоторых местах. Также доступны экспресс-тесты ПЦР на основе стула [ 21 ]. Хотя эти тесты сталкиваются с одними и теми же препятствиями для принятия, а также требуют лабораторного оборудования и навыков, они могут обеспечить быструю диагностику и тестирование устойчивости к противомикробным препаратам в одном неинвазивном тесте.
Обычно доступны серологические тесты на антитела. Хотя они полезны в качестве сероэпидемиологических исследований, этим тестам часто не хватает чувствительности и специфичности, необходимых для принятия решений у отдельных пациентов, и, как правило, они не очень полезны. Их необходимо проверять для конкретных местоположений, и проблема ложных результатов из-за перекрестной реактивности решалась редко. В сообществе с умеренной распространенностью H. pylori точность этих тестов не может превышать 50%.
6.3 Тестирование для оценки результата после эрадикационной терапии
Поскольку успех эрадикации очень разный, в идеале оценку результатов следует проводить у всех пациентов, хотя это не всегда возможно. Приоритет следует отдавать тем, кто по-прежнему подвержен наибольшему риску причинения вреда, если инфекция продолжается, например тем, кто лечится от осложненной язвенной болезни (кровотечение или перфорация).
Тестирование на основе биопсии может использоваться для определения результата после эрадикационной терапии, когда требуется эндоскопия (например, для оценки заживления язвы желудка и исключения неоплазии или для изучения неблагоприятного гистологического исследования). В противном случае предпочтительны неинвазивные тесты. UBT и анализы кала следует делать не менее чем через 1 месяц после завершения эрадикационной терапии. Чтобы свести к минимуму ложноотрицательные результаты, пациенту не следует принимать антибиотики или соединения висмута в течение как минимум месяца перед тестированием, а также следует избегать использования ингибитора протонной помпы (ИПП) как минимум в течение одной, а лучше двух недель. Серология бесполезна для оценки результата, поскольку уровни антител часто сохраняются в течение многих лет после терапии. Несмотря на широкую валидацию неинвазивных диагностических тестов, в частности дыхательных тестов,
6.4 Диагностические пути
Выбор диагностического теста в значительной степени зависит от клинического контекста, доступности, опыта и стоимости. Если доступны все методы диагностики, ключевой вопрос заключается в том, требуется ли эндоскопия для исследования симптомов или признаков заболевания верхних отделов кишечника. В более развитых странах с низкой распространенностью, оценка гастроэзофагеального рефлюкса (ГЭРБ), функциональной диспепсии, кардии и рака пищевода является обычным показанием для эндоскопии, и в это время обычно проводится биопсия желудка на наличие H. pylori . Хеликобактер пилорипо-прежнему является проблемой в таких регионах, особенно в подгруппах повышенного риска, таких как пожилые пациенты и лица с более низким социально-экономическим статусом, или мигранты из регионов с высокой распространенностью. В этих странах неинвазивная стратегия «тестируй и лечь» с использованием UBT была проверена на более молодых пациентах и является рентабельной, хотя использование этой стратегии может сокращаться. Вместо этого в первичной медико-санитарной помощи часто проводится эмпирическое испытание терапии ИПП с обращением к эндоскопии, если симптомы не исчезают. Хотя это популярно, это проблематично, когда симптомы не типичны для ГЭРБ, а идеальная продолжительность такого испытания лечения неясна. Это может привести к невозможности диагностики H. pylori.Хотя этот организм может быть случайным при проявлении, лечение молодых людей связано со значительным долгосрочным снижением риска. Экономическая эффективность стратегий лечения H. pylori в странах с хорошими ресурсами и низкой распространенностью зависит от местных затрат на здравоохранение.
В странах с более высокой распространенностью и врач, и пациент часто отдают предпочтение немедленной эндоскопии из-за опасения рака желудка, хотя, как уже отмечалось, неясно, улучшает ли это выживаемость, когда пациенты обращаются с симптомами. При принятии индивидуального решения необходимо учитывать предварительную вероятность заражения, возраст пациента, характер симптомов или признаков, а также местную распространенность язвенной болезни и рака желудка.
6.5 Эмпирическая терапия в регионах с низким уровнем ресурсов
В тех случаях, когда доступ к эндоскопическим или неинвазивным средствам диагностики инфекции H. pylori очень ограничен , решения должны приниматься эмпирически, исходя из клинических условий. Язвенная болезнь может быть сильно заподозрена на основании клинических данных, если в анамнезе есть периодическая боль в верхнем отделе кишечника и / или любое раннее или недавнее кровотечение из верхних отделов желудочно-кишечного тракта. В регионах, где известно, что распространенность H. pylori высока, а язвенная болезнь является обычным явлением, целесообразно использовать эмпирическую эрадикационную терапию для предположительного клинического диагноза язвенной болезни (рис. 3). В когорту, пролеченную таким образом, будут входить многие люди с язвенной болезнью, которые получат большую пользу. В него также будут включены пациенты с H. pylori.–Ассоциированный гастрит, но без активной язвы. В этой группе исчезновение симптомов происходит чаще, чем при использовании любой другой терапии (обычно ИПП), и, что важно, успешная терапия снижает пожизненные риски язвенной болезни и рака желудка. Также было показано, что лечение язвенной болезни и гастрита является рентабельным.
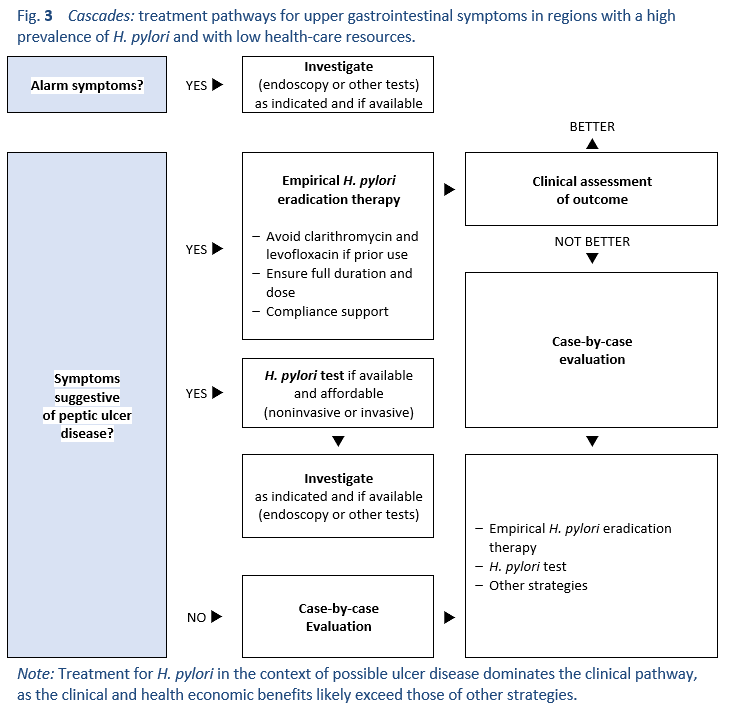
При эмпирической эрадикационной терапии, основанной на симптомах, будет проходить лечение неинфицированная подгруппа, которая может иметь другие диагнозы. Эта группа не получит выгоды от эрадикационной терапии, при этом существуют затраты и ненужное использование антибиотиков, но вероятность серьезного вреда мала, и общая польза для группы, получавшей лечение, оправдывает такой подход. Действительно, Азиатско-Тихоокеанская консенсусная группа по H. pylori особо одобрила такой подход в регионах, где H. pyloriи язвенная болезнь - обычное явление, и многие люди не имеют доступа к исследованиям ни по экономическим, ни по географическим причинам. Эмпирическое использование терапии ИПП, вероятно, будет менее эффективным, чем первоначальное лечение. Такой подход должен поддерживаться программами обучения медицинских работников распознаванию симптомов, которые с большей вероятностью связаны с язвенной болезнью, и выборочному применению этой стратегии. В этих бедных ресурсами регионах лечение всех симптомов со стороны верхних отделов кишечника с помощью такого подхода труднее оправдать.
Применение НПВП широко распространено, а язвенная болезнь, связанная с НПВП, является обычным явлением и может сосуществовать с инфекцией H. pylori . В эмпирической обстановке подозрения на язвенную болезнь, когда используются НПВП (включая аспирин), разумно как лечить от H. pylori, так и снизить риск НПВП, прекратив использование этих агентов и назначив пациенту ИПП для лечения через несколько недель после завершения эрадикационной терапии.
Рекомендации по передовой практике
В регионах с ограниченными ресурсами и высокой распространенностью, в которых диагностическое тестирование недоступно, наличие в анамнезе хронической язвенной болезни - периодической боли в верхнем отделе кишечника и / или прошлой или настоящей мелены - предполагает высокую вероятность язвенной болезни H. pylori и оправдывает эмпирическую эрадикационную терапию, особенно у пациентов, не принимавших в анамнезе НПВП или аспирин.
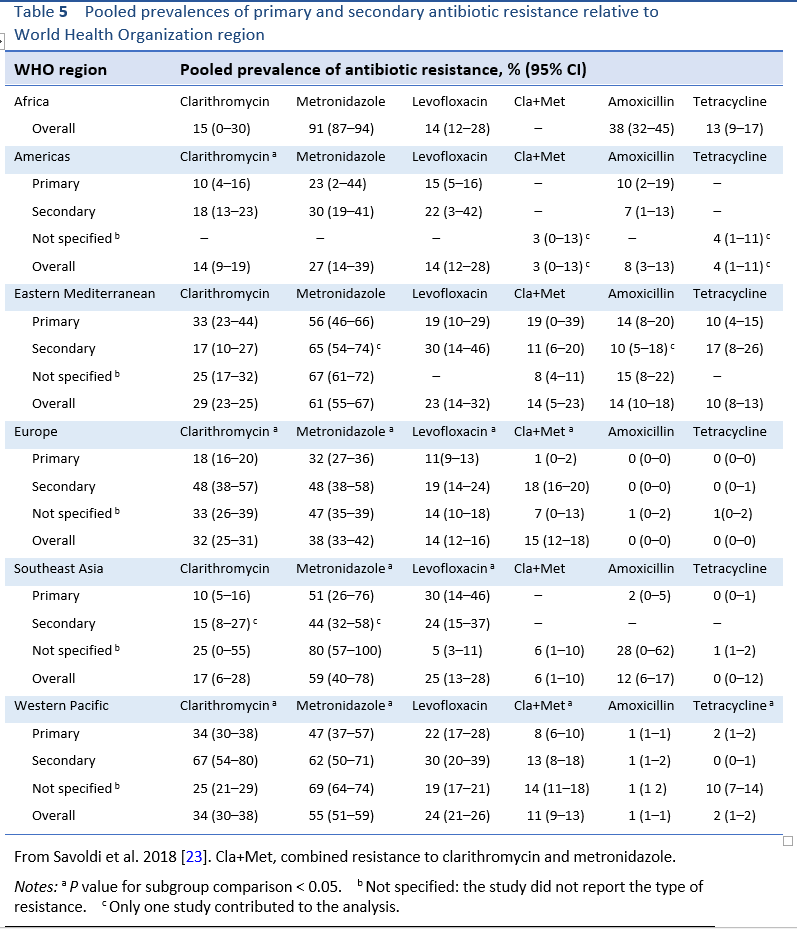
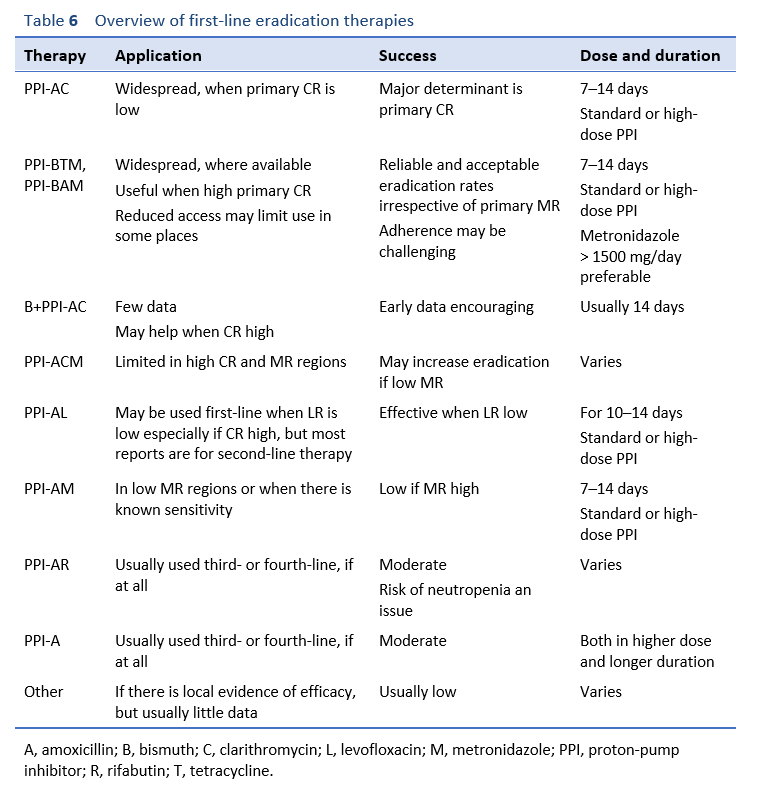
Огромное количество исследований посвящено вопросам терапии, и доступны многочисленные экспертные руководства, рекомендующие выбор терапии. Однако большая часть литературы и рекомендаций поступает из стран с хорошо обеспеченными ресурсами и относительно немного из стран с ограниченными ресурсами, которые несут основное бремя болезней, вызываемых H. pylori . Установлены универсальные принципы антибактериальной терапии. Однако существуют ключевые вопросы, которые необходимо решать на местном уровне, чтобы определить наилучшую местную практику, поскольку структура устойчивости к противомикробным препаратам и, следовательно, уровни ликвидации различаются в зависимости от региона [ 23 , 24] и другие местные факторы, такие как стоимость и доступность лекарств, влияют на выбор терапии. Ключевые принципы, определяющие выбор эрадикационной терапии, изложены в таблице 4.

8.1 Выбор эрадикационной терапии первой линии
Применение этих принципов терапии обеспечит наилучшие возможные результаты. В регионах с хорошо обеспеченными ресурсами лечение может основываться на высококачественных испытаниях и данных аудита и культуры; в бедных ресурсами регионах, опора на знания сообщества или личного использования антибиотиков и любого локального аудита результатов будут влиять на использование терапии рекомендуется в руководствах из других [ 4 - 12 ].
8.1.1 Тройная терапия ИПП, амоксициллин, кларитромицин
Во многих частях мира тройная терапия, включающая ингибитор протонной помпы (ИПП) с амоксициллином и кларитромицином (ИПП-АС), по-прежнему является наиболее часто применяемой терапией первой линии. Эта комбинация была первой очень широко рекомендованной терапией и вытеснила менее эффективные тройные методы лечения. Он очень хорошо оценивался на протяжении многих лет. Основным фактором, определяющим успех эрадикации с помощью этой комбинации, является устойчивость к кларитромицину (CR) до начала лечения. Распространенность устойчивости к антибиотикам, особенно CR, широко варьируется во всем мире (Таблица 5). В тех случаях, когда кларитромицин использовался и обычно используется в качестве монотерапии для лечения других инфекций, уровень CR часто высок и увеличивается. Есть мнения, что от этой терапии следует отказаться в тех областях, где, как известно, частота первичного полного ответа составляет 15–20% или выше. из-за воздействия, которое это оказывает на показатели ликвидации. В некоторой степени произвольный минимальный уровень эрадикации в 80% на основе намерения лечить часто указывается в качестве ориентира для приемлемой терапии. Это обычная скорость эрадикации ИПП-АС в реальных исследованиях в областях, где частота ОК является умеренной или низкой (т. Е. Ниже 15–20%). Неприемлемо более низкие результаты эрадикации могут наблюдаться в странах, в которых распространенность CR выше.
Ключевое утверждение
Основным фактором, определяющим успех эрадикации ИПП-АС, является устойчивость к кларитромицину до начала лечения.
Оптимальная продолжительность терапии - предмет разногласий. Недавние призывы к универсальной 14-дневной терапии PPI-AC обычно исходят из регионов с более высоким CR. Первоначальные исследования в основном длились 7 дней, хотя на эту продолжительность мог повлиять дизайн регистрационного исследования. Сторонники более продолжительной терапии указывают на несколько более высокие показатели эрадикации в систематических обзорах. Однако есть и другие факторы, влияющие на продолжительность терапии, особенно в странах с ограниченными ресурсами. Добавление второй недели терапии может повысить уровень эрадикации, как правило, примерно на 10%. Это означает, что количество пациентов, которым необходимо пройти курс лечения с дополнительной неделей терапии, чтобы достичь еще одного успеха лечения, составляет 10. Цена этого более высокого уровня эрадикации, если она будет достигнута, включает удвоение стоимости лечения. что является серьезной проблемой в регионах с ограниченными ресурсами. (Следует отметить, что стоимость недели тройной терапии в регионах с очень бедными ресурсами может быть такой же, как и недельный заработок для самых низкооплачиваемых.) Риск побочных эффектов значительно возрастает при длительном приеме антибиотиков, равно как и вероятность несоблюдения режима лечения. . Альтернативой является назначение более короткой терапии, когда комплаентность, вероятно, будет выше, а побочные эффекты и стоят меньше, при том понимании, что на 10% больше пациентов могут нуждаться в терапии второго ряда. Общее использование антибиотиков будет намного ниже при использовании второй стратегии, если показатели эрадикации первой линии будут, по крайней мере, умеренно высокими. В некоторых странах с хорошими ресурсами обычно рекомендуется более длительная терапия, но требуется больше моделирования более коротких курсов в регионах с ограниченными ресурсами. Следует также отметить, что приемлемые показатели эрадикации при 1-недельной терапии ИПП-АС были зарегистрированы в нескольких странах, а дополнительная польза от более длительного курса не изучалась. Оптимальная дозировка ИПП (стандартная или высокая доза) и кларитромицина (250 мг или 500 мг два раза в день) не была определена в большинстве регионов. В регионах с высоким CR ни одна, ни две недели этой терапии не могут достичь приемлемых показателей эрадикации. В таких местах выбор терапии первой линии варьируется. Ни одна, ни две недели этой терапии не могут достичь приемлемых показателей эрадикации. В таких местах выбор терапии первой линии варьируется. Ни одна, ни две недели этой терапии не могут достичь приемлемых показателей эрадикации. В таких местах выбор терапии первой линии варьируется.
Роль и значение калий-конкурентных блокаторов кислоты, таких как фонопразан, вместо ИПП в любой эрадикационной терапии становится все более очевидным. Эти препараты не подвержены полиморфизму CYP2C19 и приводят к более равномерному и сильному ингибированию секреции желудочного сока [ 25 ].
8.1.2 Четверная терапия на основе висмута
Другим основным выбором для терапии первой линии, особенно в регионах с высоким первичным CR, по-прежнему остается четырехкратная терапия на основе висмута. Наиболее изученная схема включает ИПП, висмут, тетрациклин и метронидазол (ИПП-BTM). Это лечение выдержало испытание временем, поскольку оно приводит к надежным и приемлемым показателям эрадикации независимо от первичной резистентности к метронидазолу (MR), поскольку добавление PPI к BTM, по-видимому, преодолевает MR. Хорошие результаты были достигнуты при 7-дневной терапии, хотя есть сторонники более длительного (10–14-дневного) лечения. Основными недостатками этой терапии являются неуклюжий режим дозирования (поскольку она обычно назначается четыре раза в день) и общие, но обычно легкие побочные эффекты, которые могут ухудшить приверженность. Ограниченный доступ к висмуту и тетрациклину может ограничивать использование этого лечения в некоторых местах. Однако,
О четырехкратной терапии с заменой амоксициллина на тетрациклин (ИПП-БАМ) сообщалось давно, и она используется реже, но может дать приемлемые результаты.
Совсем недавно сообщалось о преобразовании стандартной тройной терапии ИПП-АС в четырехкратную терапию путем добавления висмута (В + ИПП-АС) с благоприятными результатами в некоторых регионах [ 26 ]. Ценность этого для преодоления CR еще не полностью определена, но заслуживает детальной оценки.
8.1.3 Невисмутовая четырехкомпонентная терапия
Есть сторонники невисмутовой четырехкомпонентной терапии, обычно подразумевающей добавление метронидазола к тройной терапии ИПП-АС (ИПП-АКМ). Это может повысить уровень эрадикации, если показатели МР низкие или умеренные, но вряд ли окажутся очень полезными во многих регионах мира, где первичная МР и / или ПР высоки. Более того, пациенты, у которых лечение не помогает, часто обнаруживают двойную резистентность. Этот тип сопутствующей терапии изучался в странах с хорошо обеспеченными ресурсами, но редко в странах с ограниченными ресурсами. Последовательные или гибридные схемы менее изучены, по всей видимости, не обеспечивают превосходной эрадикации, их неуклюже прописывать и возникают особые проблемы с соблюдением режима лечения. В результате они не рекомендуются.
Если чувствительность к метронидазолу известна в результате тестирования пациента, ИПП-АМ может использоваться в качестве терапии первой линии с разумными результатами. Он также подходит для мест, где, как известно, MR низкий среди населения.
8.1.4 Тройная терапия левофлоксацином
Тройная терапия левофлоксацином (ИПП, амоксициллин и левофлоксацин, ИПП-AL в течение 10–14 дней) использовалась в качестве терапии первой линии, когда резистентность к левофлоксацину (LR) известна или предположительно низкая, но эта комбинация широко не изучалась в эта роль, причем большинство сообщений относится к терапии второй линии. Сообщения о высоких показателях устойчивости к левофлоксацину в некоторых странах ограничивают применимость этой терапии в этих регионах. Лечение обычно хорошо переносится. В последнее время высказывались опасения по поводу рисков использования фторхинолонов. При приеме левофлоксацина это связано с редким риском тендинита или миозита. Точная распространенность этого побочного эффекта недостаточно документирована. но он, по-видимому, чаще встречается у пожилых людей и людей с воспалительным артритом или почечной недостаточностью, и его лучше избегать в этих подгруппах высокого риска, если существуют альтернативы. Более высокая доза левофлоксацина и, возможно, высокие дозы ИПП могут быть связаны с лучшим успехом эрадикации. Также использовался родственный хинолон моксифлоксацин. Он менее изучен и имеет более широкий спектр действия, поэтому, как правило, не является предпочтительным перед левофлоксацином.
Есть ряд других менее изученных методов лечения, которые, тем не менее, были рекомендованы в различных обзорах. Фуразолидон, например, использовался в местах, где CR и LR высокие, но качественные данные, подтверждающие его ценность, скудны по сравнению с общепринятыми методами лечения, и его точная роль еще предстоит определить.
При использовании устойчивости к противомикробным препаратам путем посева или экспресс-теста ПЦР индивидуальным пациентам может быть назначена индивидуальная терапия. Это, вероятно, будет иметь наибольшее значение в регионах с более высоким первичным CR, что позволит избежать использования кларитромицина в терапии первой линии. Валидация и принятие ПЦР на основе стула дает возможность распространить это преимущество на первичную медико-санитарную помощь и в обстоятельствах, когда эндоскопия не требуется или недоступна.
В таблицах 6 и 7 представлен обзор и краткое изложение схем лечения первой линии и их состава.
8.2 Выбор второй и последующих методов эрадикационной терапии
Терапия второй линии или спасательная терапия после неудачной попытки искоренения первой линии хорошо изучены в некоторых регионах, но полностью отсутствуют данные по многим регионам с ограниченными ресурсами [ 4 - 12 ].
8.2.1 Четырехкратная терапия на основе висмута и тройная терапия левофлоксацином
Наиболее часто изучаемые и используемые терапии второй линии включают стандартную четырехкратную терапию на основе висмута в течение 7–14 дней и тройную терапию левофлоксацином в течение 10–14 дней, как описано выше. Показано, что в обоих случаях уровень эрадикации превышает 80%. Выбор между ними зависит от того, известны ли местные показатели первичной устойчивости к левофлоксацину, доступность, опыт, приверженность и стоимость. Часто рекомендуется более длительная продолжительность терапии (например, 14 дней), но необходимы данные о местных исходах, затратах и приверженности. Когда эти методы лечения не помогают, обычно третьим выбором является другая терапия. В опытных центрах общий уровень эрадикации при разумно выбранных методах лечения после неэффективности первой линии должен приближаться к 98% после трех сеансов лечения.
8.2.2 Другие методы лечения спасения
Другие использованные методы лечения включают тройную терапию на основе рифабутина (ИПП-АР). Как правило, он менее эффективен, и риск значительной нейтропении может достигать 1%, что, как правило, ограничивает его использование. Обычно этого избегают в регионах с высокой распространенностью туберкулеза. Высокие дозы двойного ИПП с терапией амоксициллином (ИПП-А) применялись с некоторым успехом. Невисмутовая четырехкомпонентная терапия, как правило, неэффективна в качестве терапии спасения из-за вторичных CR и MR. Если чувствительность к метронидазолу известна после тестирования, ИПП-АМ может использоваться в качестве терапии второй линии с разумными результатами, но обычно эмпирически не используется для терапии второй линии. Фуразолидон использовался и рекомендуется в качестве компонента терапии в некоторых регионах. Есть несколько высококачественных исследований эрадикации, которые включают этот препарат, и существует нехватка рандомизированных исследований. Обеспокоенность по поводу его безопасности и использования привела к тому, что он стал недоступен в Соединенных Штатах и Европейском Союзе.
Когда были соблюдены соответствующие методы лечения и терапия не принесла результатов, следует избегать специальных методов лечения по прихоти врача, и следует принимать продолжающуюся инфекцию, если только не доступны специализированные знания или клинические испытания. У некоторых пациентов, например, с рецидивирующей язвой, неэффективность эрадикации может привести к необходимости поддерживающей антисекреторной терапии.
8.3 Варианты лечения пациентов с аллергией на пенициллин
Пациентам с аллергией на пенициллин можно заменить метронидазол на амоксициллин и сочетать его с ИПП и кларитромицином (ИПП-МС). Однако первичная МРТ снижает эффективность этого. Квадратная терапия висмутом является очень хорошей альтернативой (PPI-BTM). Если оба этих метода лечения потерпят неудачу, дальнейшие возможности будут ограничены. У пациентов с отдаленной, неопределенной или маловероятной историей аллергии на пенициллин и при наличии ресурсов может быть проведена формальная оценка аллергии на пенициллин 1 типа. Это включает измерение антител к пенициллину с последующим кожным уколом, а в случае отрицательного результата - пероральным контрольным заражением. Когда это проводится у пациентов из группы низкого риска, до 80% таких пациентов не страдают аллергией на пенициллин. и их можно безопасно лечить с помощью препаратов, содержащих амоксициллин, по мере необходимости (обычно PPI-AL или PPI-AC, если кларитромицин изначально не применялся). Было показано, что такая стратегия позволяет у большинства пациентов успешно проводить эрадикационную терапию. Если ранее имелась четкая история реакции типа 1, предполагается наличие аллергии и тестирование не показано.
8.4 Пути лечения
Таким образом, в регионах с хорошо обеспеченными ресурсами, в которых известны местные показатели CR и MR (а иногда и LR), выбор лечения, основанный на фактических данных, в регионах с более низким CR обычно - это PPI-AC в качестве первой линии, с PPI-BTM или PPI-AL терапии в качестве второй и третьей линии, в любом порядке. В регионах с более высоким уровнем CR можно использовать PPI-BTM. B + PPI-AC или PPI-AL могут быть альтернативными терапиями первой линии. Выбор второй линии зависит от того, что было использовано первым: можно использовать PPI-BTM или PPI-AL, если они не использовались ранее.
В регионах с ограниченными ресурсами, в которых общественные CR и MR не установлены или известны как высокие, выбор терапии основан на эмпирическом аудите результатов, личном анамнезе воздействия антибиотиков в виде монотерапии отдельным пациентом, известных уровнях использования в сообществе таких препаратов, наличие и стоимость (Таблица 8). PPI-AC по-прежнему широко используется в сочетании с PPI-BTM или PPI-AL, или даже безвисмутовой четырехкратной терапией в качестве альтернативной терапии первой линии или терапии спасения. Однако, если известно, что терапия кларитромицином первой линии приводит к плохим результатам, предпочтение может отдаваться одному из других описанных методов лечения. Крайне необходимы данные о показателях устойчивости к левофлоксацину, поскольку LR, по-видимому, распространен во многих регионах, а качество некоторых опубликованных данных является неопределенным. Таким образом, четырехкратная терапия PPI-BTM, вероятно, будет хорошим первым и последующим выбором, поскольку она позволяет избежать проблемы плохих результатов из-за резистентности. Однако его использование иногда ограничивается доступностью, соответствием требованиям и побочными эффектами. Какой бы терапевтический путь ни был выбран, крайне важно не повторять ту же терапию, так как это очень малоэффективная стратегия после неудачи первой линии из-за вторичной устойчивости к антибиотикам. Например, вероятность успеха при эрадикации с помощью PPI-AC может составлять 80% или более при лечении первой линии, но всего 8%, когда лечение повторяется после неудачи первой линии. Большая часть этого связана с вторичным CR. К сожалению, эта практика все еще широко распространена в некоторых местах, но ее не следует поощрять. Наконец,
Соответствующий путь выбора терапии представлен на рис.4.
8.5 Роль культуры
Обследование H. pyloriМодели резистентности для определения распространенности среди населения и изменений в распространенности будут определять выбор лечения. В некоторых странах с хорошо обеспеченными ресурсами можно адаптировать терапию на основе индивидуального тестирования чувствительности к противомикробным препаратам при эндоскопической биопсии до лечения. Однако это не является нормой в клинической практике, и в любом случае посев и субкультура для тестирования устойчивости могут потерпеть неудачу в менее опытных лабораториях. Более того, большая часть лечения проводится в учреждениях первичной медико-санитарной помощи, где проводятся неинвазивные исследования и лечение. После неудачного лечения тестирование чувствительности к антибиотикам на основе культуральных биопсий вряд ли будет играть важную роль в принятии клинических решений. Если применение кларитромицина не принесло результатов, вторичный ПР настолько распространен, что делает тестирование на него бесполезным, и следует выбрать другую терапию. Оценка МР иногда бывает полезной, если ИПП-АМ может быть вариантом, но она не влияет на выбор ИПП-ВТМ, поскольку МРТ не влияет на терапию. Левофлоксацин эмпирически используется в большинстве регионов, в которых, как известно, распространенность LR низкая. Кроме того, чувствительность in vitroХеликобактер пилори по отношению к другим антибиотикам не означает терапевтического успеха, и не следует разрабатывать специальные схемы лечения таким образом.
Если недорогие молекулярные методы биопсии (или стула) в месте оказания медицинской помощи станут широко доступными для быстрой оценки устойчивости, они могут изменить практику, оказав серьезное влияние на выбор лечения. Вполне возможно, что такие тесты могут заменить тесты на уреазу, подтвердив наличие инфекции и предоставив быстрые данные о резистентности к противомикробным препаратам для проведения индивидуальной терапии, по цене лишь немного больше, чем текущие коммерческие тесты на уреазу. Анализы на основе стула позволят проводить лечение, адаптированное к антимикробной чувствительности пациента в первичной медико-санитарной помощи, без необходимости проведения эндоскопии.
8.6 Соответствие
Какая бы терапия ни была назначена, необходимо приложить все усилия для максимального соблюдения режима лечения. Это означает, что врач, выписывающий рецепт, должен проводить время с пациентом, чтобы объяснить важность принятия всей терапии и не прерывать лечение. Это особенно важно в регионах, где правила, регулирующие использование антибиотиков, могут быть слабыми или не соблюдаться, и где антибиотики можно приобрести без рецепта в аптеках. Пациенты могут покупать лекарства в небольших количествах в течение дня или двух, с риском непостоянства, если симптомы не исчезнут немедленно или возникнут какие-либо побочные эффекты. Ясно, что весь курс терапии следует назначать и отпускать сразу же. Неприятные побочные эффекты, такие как временное нарушение вкуса, что характерно для кларитромицина и метронидазола, - следует ожидать и объяснять, чтобы их появление не привело к прекращению терапии. Было обнаружено, что предоставление печатных материалов для поддержки дозировки и информации является полезным. Поскольку курение сигарет, как известно, является неблагоприятным прогностическим фактором для исхода, отказ от курения до и во время терапии может улучшить исходы, хотя это еще недостаточно изучено. Отказ от курения также способствует заживлению язв. Утверждается роль пробиотиков в уменьшении побочных эффектов (и, возможно, улучшении результатов), но для этого требуется больше доказательств лучшего качества. Отказ от курения до и во время терапии может улучшить результаты, хотя этот вопрос недостаточно изучен. Отказ от курения также способствует заживлению язв. Утверждается роль пробиотиков в уменьшении побочных эффектов (и, возможно, улучшении результатов), но для этого требуется больше доказательств лучшего качества. Отказ от курения до и во время терапии может улучшить результаты, хотя этот вопрос недостаточно изучен. Отказ от курения также способствует заживлению язв. Утверждается роль пробиотиков в уменьшении побочных эффектов (и, возможно, улучшении результатов), но для этого требуется больше доказательств лучшего качества.
Рекомендации по надлежащей практике
Пациентам следует всегда предупреждать, что успешное искоренение болезни зависит от соблюдения режима лечения. Следует уделить время тому, чтобы проконсультировать пациента, объяснить, как принимать комплексную лекарственную терапию и предвидеть побочные эффекты. Следует подчеркнуть необходимость завершения лечения. Письменная или графическая информация также может способствовать соблюдению требований.
8.7 После лечения
В идеале оценка результатов должна проводиться у всех пролеченных пациентов, хотя на практике это недоступно во многих местах. Когда изначально была проведена эндоскопия и была выявлена атрофия желудка и / или кишечная метаплазия, необходимо принять решение об эндоскопическом наблюдении за слизистой оболочкой [ 27]. Это может принести пользу отдельным пациентам, но общее снижение смертности от рака желудка еще предстоит четко продемонстрировать. При обнаружении очаговой дисплазии слизистой оболочки желудка высокой степени эти области могут быть удалены эндоскопически, но более поздняя форма неоплазии требует хирургического вмешательства. Дисплазию можно обнаружить с помощью улучшенной визуализации или картирования образцов биопсии без дискретных эндоскопически видимых повреждений. Этим пациентам требуется эндоскопическая переоценка, предпочтительно с помощью эндоскопии с улучшенным изображением и увеличением, в течение 6 месяцев для дисплазии высокой степени и 12 месяцев для дисплазии низкой степени.
Поскольку атрофия и кишечная метаплазия являются обычным явлением, эндоскопическое наблюдение потребует значительных ресурсов эндоскопии и будет иметь альтернативные издержки по сравнению с другими потребностями здравоохранения. Таким образом, как правило, наблюдение предлагается только лицам с повышенным риском. Высокий риск обычно означает наличие более обширных изменений слизистой оболочки желудка (включая антральный отдел и тело желудка) и / или семейный анамнез рака желудка. Идеальная стратегия еще не определена. Точное эндоскопическое обнаружение и характеристика изменений слизистой оболочки требует специальной подготовки и современных эндоскопов, а также квалифицированных патологов.
9,1 Австралия
В Австралии зарегистрированы низкие показатели устойчивости к кларитромицину (6–8%) и высокие показатели устойчивости к метронидазолу (45–50%). Данных о левофлоксацине немного, но первичная резистентность кажется очень низкой, за возможным исключением случаев у мигрантов из регионов с высокой резистентностью. В результате стандартная тройная терапия с применением ИПП, амоксициллина и кларитромицина по-прежнему является рекомендованной терапией первой линии, если и до тех пор, пока не появятся доказательства роста резистентности к кларитромицину. Сообщается, что уровень эрадикации за 7 дней составляет 80–87%. Четырнадцатидневная терапия формально не изучена. Спасательная терапия включает тройную терапию левофлоксацином в течение 10 дней (уровень эрадикации 80–90%) и четырехкратную терапию стандартной дозой (ИПП, висмут, тетрациклин и метронидазол) в течение 7–14 дней с аналогичными результатами. Левофлоксацин, тетрациклин, и висмут не регистрируются на местном уровне, поэтому не часто используются в терапии первой линии. Эти лекарства должны быть получены из-за границы по специальной схеме или через аптеки-рецепторы, когда это необходимо для лечения спасения. Тройная терапия рифабутином использовалась реже (эрадикация 76%). Сопутствующие методы лечения на местном уровне не изучались.
9.2 Тихоокеанский регион
В настоящее время отсутствуют данные о местной резистентности и мало систематических данных для оценки результатов терапии. Поэтому выбор терапии обычно экстраполируется из международных руководств и определяется доступностью лекарств. Обычно выбирают тройную терапию кларитромицином, включающую ИПП и амоксициллин или метронидазол, несмотря на клинические подозрения на высокую MR, влияющую на эффективность последнего. Стоимость, доступность, местный опыт и приверженность терапии - все это препятствия на пути к эффективному лечению. Нет проверенных данных по спасательной терапии. Не рекомендуется назначать специальную терапию и повторную терапию кларитромицином после неэффективности первой линии.
9,3 Юго-Восточная Азия
Имеются убедительные доказательства того, что устойчивость к амоксициллину и тетрациклину низкая и стабильная (<5%), но MR обычно высока (30–100%). CR увеличивается, но значительно варьируется в странах Юго-Восточной Азии (от 2% до 43%). Для большинства схем следует использовать 14-дневную продолжительность, если нет местных доказательств, подтверждающих надежные показатели эрадикации при более короткой продолжительности. В идеале, схемы первого ряда следует рассматривать на основе показателей местной устойчивости к антибиотикам из-за широкого диапазона устойчивости к антибиотикам в разных странах. Сообщается, что PPI-BTM имеет показатель успешности> 90%. Схемы второго ряда должны содержать антибиотики, которые ранее не использовались, или те, к которым маловероятно развитие устойчивости, такие как амоксициллин или тетрациклин. Следует рассмотреть возможность использования PPI-BTM, если он еще не использовался.Mycobacterium tuberculosis . Если после второй попытки эрадикационное лечение не удалось, следует рассмотреть возможность проведения тестов на чувствительность к антибиотикам.
9.4 Евразия
На основе пилотного исследования распространенность H. pyloriсеропозитивность среди здоровых взрослых в Армении составляет 41,5%, увеличиваясь с возрастом (13,6% в возрастной группе 18–25 лет и 83,3% в возрастной группе старше 65 лет). Уровень устойчивости к кларитромицину в 2018 году был всего 3,6%, а к фторхинолонам - 12,8%. Однако необходимы новые исследования, особенно во время пандемии COVID-19, когда в стране наблюдается беспрецедентный рост числа рецептов на макролиды и респираторные фторхинолоны. Тетрациклин доступен только в таблетках по 100 мг, что делает обычную четырехкратную схему лечения очень неудобной. Местные рекомендации, адаптированные из Маастрихтских руководств, предлагают 14-дневную тройную терапию кларитромицином в качестве лечения первой линии и модифицированную четырехкратную терапию висмутом (ИПП, висмут, амоксициллин, и метронидазол) в качестве альтернативной терапии первой линии. Варианты второй линии включают трех- или четырехкратное лечение левофлоксацином. Ни один из режимов эрадикации не изучался на местном уровне на предмет эффективности.
9,5 Западная Европа
CR очень важен для выбора терапии первой линии. Это варьируется между европейскими странами и внутри них. Поэтому мониторинг устойчивости к антибиотикам по-прежнему важен на уровне населения. Последние данные Европейского реестра от> 30 000 пациентов из 27 стран [ 28], показал уровень резистентности до лечения в 23% для кларитромицина, 32% для метронидазола и двойной резистентности в 13%. Существует дихотомия с более низким CR в центральной и северной Европе; в Германии первичный CR все еще ниже порогового уровня в 15%. Тройная терапия амоксициллином и кларитромицином в течение 14 дней все еще эффективна в этих условиях и обычно используется в качестве лечения первой линии. В регионах, где первичный CR составляет> 15%, в качестве лечения первой линии рекомендуется четырехкратное лечение висмутом в течение 10 дней (или 14 дней, если компоненты этого режима назначаются индивидуально). Сопутствующая терапия, которая включает три антибиотика вместо двух, используемых при четырехкратном лечении на основе висмута, непопулярна в большинстве стран. От метронидазола в тройной терапии ИПП по большей части отказались, и теперь он применяется только в отдельных случаях (например,
Повышение устойчивости к левофлоксацину исключило этот антибиотик как компонент любой схемы лечения первого ряда. Его использование вызывает все большее беспокойство, даже если оно используется в качестве лечения второй линии. Рифабутин эффективен в лечении третьей линии и рекомендуется как компонент режима спасения после повторной неудачи лечения.
Европейские рекомендации делают упор на тестирование ( 13 C-UBT) для оценки индивидуального ответа на лечение. После неудачного лечения рекомендуется провести тестирование на резистентность к обычно используемым антибиотикам.
9,6 Южная Европа
CR очень важен для выбора терапии первой линии. Это варьируется между европейскими странами и внутри них. Поэтому мониторинг устойчивости к антибиотикам по-прежнему важен на уровне населения. Последние данные Европейского реестра от> 30 000 пациентов из 27 стран [ 28], показал уровень резистентности до лечения в 23% для кларитромицина, 32% для метронидазола и двойной резистентности в 13%. Существует дихотомия с более низким CR в центральной и северной Европе; в Германии первичный CR все еще ниже порогового уровня в 15%. Тройная терапия амоксициллином и кларитромицином в течение 14 дней все еще эффективна в этих условиях и обычно используется в качестве лечения первой линии. В регионах, где первичный CR составляет> 15%, в качестве лечения первой линии рекомендуется четырехкратное лечение висмутом в течение 10 дней (или 14 дней, если компоненты этого режима назначаются индивидуально). Сопутствующая терапия, которая включает три антибиотика вместо двух, используемых при четырехкратном лечении на основе висмута, непопулярна в большинстве стран. От метронидазола в тройной терапии ИПП по большей части отказались, и теперь он применяется только в отдельных случаях (например,
Повышение устойчивости к левофлоксацину исключило этот антибиотик как компонент любой схемы лечения первого ряда. Его использование вызывает все большее беспокойство, даже если оно используется в качестве лечения второй линии. Рифабутин эффективен в лечении третьей линии и рекомендуется как компонент режима спасения после повторной неудачи лечения.
Европейские рекомендации делают упор на тестирование ( 13 C-UBT) для оценки индивидуального ответа на лечение. После неудачного лечения рекомендуется провести тестирование на резистентность к обычно используемым антибиотикам.
9,7 Северная Америка
В Северной Америке наблюдается разная устойчивость к кларитромицину (17–32% в различных исследованиях) и высокая устойчивость к метронидазолу (44%). В недавнем исследовании сообщалось, что устойчивость к амоксициллину составляет 6%, а устойчивость к рифабутину - 0%. Руководства США рекомендуют назначать тройную терапию кларитромицином в качестве терапии первой линии только пациентам, не подвергавшимся воздействию макролидов в анамнезе и проживающим в районах, где наблюдается резистентность к кларитромицину против H. pylori.изолятов, как известно, низкий. Этим критериям соответствуют некоторые пригородные и сельские районы страны. Лечение первой линии с четырехкратной терапией висмутом или сопутствующей терапией, состоящей из ИПП, кларитромицина, амоксициллина и метронидазола, рекомендуется в качестве терапии первой линии в большинстве областей. Комбинация рифабутина, амоксициллина и омепразола была одобрена для лечения H. pylori в США. Его роль в начальной терапии еще предстоит определить.
9,8 Южная и Центральная Америка
Исследования устойчивости к кларитромицину в Южной и Центральной Америке по-прежнему немногочисленны, а по некоторым данным показатели уже превышают 20%. Самые высокие показатели распространенности описаны в Мексике, Колумбии, Аргентине и Бразилии. Неизбирательное использование азитромицина (недорогой препарат) может привести к отбору мутантов, устойчивых к макролидам, и к увеличению частоты полного ответа. Были зарегистрированы низкие показатели устойчивости к амоксициллину, но некоторые исследования показывают высокий процент в Бразилии. Если эта тенденция подтвердится, это станет тревожной ситуацией из-за центральной роли этих методов лечения антибиотиками.
Классический тройной режим с ИПП, амоксициллином и кларитромицином в течение 7–14 дней до сих пор остается наиболее широко используемым режимом, за ним следует четырехкратная терапия висмутом в качестве альтернативы или терапии второй линии и терапия на основе левофлоксацина в качестве спасательного варианта. Сообщается, что устойчивость к левофлоксацину недостаточна, но высокие уровни описаны в Перу. Сопутствующее использование метронидазола является обычным явлением для четверной терапии первого ряда, но сообщаемая распространенность резистентности превышает 50% в Центральной Америке, Мексике и в некоторых странах Южной Америки, таких как Бразилия и Колумбия.
Сообщалось о частоте рецидивов более 3–5% в год с учетом географической изменчивости; данные по многим регионам отсутствуют. Барьеры, которые необходимо преодолеть, включают стоимость лекарств, более строгое соблюдение рекомендаций врачами, отсутствие UBT во многих регионах, недоступность солей висмута, фуразолидона и рифабутина в некоторых странах, а также отсутствие высококачественных местных исследований для утвердить схемы лечения против H. pylori . Большинство систем здравоохранения в регионе все еще работают неоптимально по этим вопросам.
.
Вы можете приобрести Набор реагентов для клинической лабораторной диагностики Helicobacter pylori «RU-Test Helicobacter pylori» (ТУ 21.20.23-001-16185645-2018) в маркетплейсе на ЭндоЭксперт.ру по ссылке:
Список литературы:
2. Kusters JG, van Vliet AHM, Kuipers EJ. Pathogenesis of Helicobacter pylori infection. Clin Microbiol Rev. 2006 Jul;19(3):449–90.
3. Chmiela M, Kupcinskas J. Review: pathogenesis of Helicobacter pylori infection. Helicobacter. 2019 Sep;24 Suppl 1:e12638.
4. Fock KM, Katelaris P, Sugano K, Ang TL, Hunt R, Talley NJ, et al. Second Asia-Pacific consensus guidelines for Helicobacter pylori infection. J Gastroenterol Hepatol. 2009 Oct;24(10):1587–600.
5. Mahachai V, Vilaichone R-K, Pittayanon R, Rojborwonwitaya J, Leelakusolvong S, Maneerattanaporn M, et al. Helicobacter pylori management in ASEAN: the Bangkok consensus report. J Gastroenterol Hepatol. 2018 Jan;33(1):37–56.
6. Malfertheiner P, Megraud F, O’Morain CA, Gisbert JP, Kuipers EJ, Axon AT, et al. Management of Helicobacter pylori infection—the Maastricht V/Florence Consensus Report. Gut. 2017;66(1):6–30.
7. Coelho LGV, Marinho JR, Genta R, Ribeiro LT, Passos M do CF, Zaterka S, et al. IVth Brazilian consensus conference on Helicobacter pylori infection. Arq Gastroenterol [Internet]. 2018 Apr 16 [cited 2018 May 10]; Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0004-28032018005001101&lng=en&tlng=en
8. Fallone CA, Chiba N, van Zanten SV, Fischbach L, Gisbert JP, Hunt RH, et al. The Toronto consensus for the treatment of Helicobacter pylori infection in adults. Gastroenterology. 2016 Jul;151(1):51-69.e14.
9. Mitchell H, Katelaris P. Epidemiology, clinical impacts and current clinical management of Helicobacter pylori infection. Med J Aust. 2016 Jun 6;204(10):376–80.
10. Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG clinical guideline: treatment of Helicobacter pylori infection. Am J Gastroenterol. 2017 Feb;112(2):212–39.
11. Sugano K, Tack J, Kuipers EJ, Graham DY, El-Omar EM, Miura S, et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut. 2015 Sep;64(9):1353–67.
12. Liu WZ, Xie Y, Lu H, Cheng H, Zeng ZR, Zhou LY, et al. Fifth Chinese National Consensus Report on the management of Helicobacter pylori infection. Helicobacter. 2018 Apr;23(2):e12475.
13. Goh K-L. Lessons learnt from the epidemiology of Helicobacter pylori infection in Malaysia: JGHF Marshall and Warren Lecture 2017. J Gastroenterol Hepatol. 2018 Jun;33(6):1177–84.
14. Warren JR, Marshall B. Unidentified curved bacilli on gastric epithelium in active chronic gastritis. Lancet Lond Engl. 1983;1(8336):1273–5.
15. World Health Organization. Cancer [Internet]. [cited 2021 Feb 20]. Available from: https://www.who.int/news-room/fact-sheets/detail/cancer
16. Ford AC, Yuan Y, Forman D, Hunt R, Moayyedi P. Helicobacter pylori eradication for the prevention of gastric neoplasia. Cochrane Database Syst Rev. 2020 Jul 6;7:CD005583.
17. Lazebnik LB, Bordin DS, Mikheeva OM, Belousova NL. [Eradication efficiency and Helicobacter pylori resistance to antibiotics in anticipation of IV TH Maastricht consensus issues publication. Editorial]. Exp Clin Gastroenterol. 2011;8:3–7.
18. Rugge M, Meggio A, Pennelli G, Piscioli F, Giacomelli L, De Pretis G, et al. Gastritis staging in clinical practice: the OLGA staging system. Gut. 2007 May;56(5):631–6.
19. Katelaris PH, Lowe DG, Norbu P, Farthing MJ. Field evaluation of a rapid, simple and inexpensive urease test for the detection of Helicobacter pylori. J Gastroenterol Hepatol. 1992 Dec;7(6):569–71.
20. Li Y, Lv T, He C, Wang H, Cram DS, Zhou L, et al. Evaluation of multiplex ARMS-PCR for detection of Helicobacter pylori mutations conferring resistance to clarithromycin and levofloxacin. Gut Pathog. 2020;12:35.
21. Pichon M, Pichard B, Barrioz T, Plouzeau C, Croquet V, Fotsing G, et al. Diagnostic accuracy of a noninvasive test for detection of Helicobacter pylori and resistance to clarithromycin in stool by the Amplidiag H. pylori+clarir real-time PCR assay. J Clin Microbiol. 2020 Mar 25;58(4).
22. Jehanne Q, Bénéjat L, Mégraud F, Bessède E, Lehours P. Evaluation of the AllplexTM H pylori and ClariR PCR assay for Helicobacter pylori detection on gastric biopsies. Helicobacter. 2020 Aug;25(4):e12702.
23. Savoldi A, Carrara E, Graham DY, Conti M, Tacconelli E. Prevalence of antibiotic resistance in Helicobacter pylori: a systematic review and meta-analysis in World Health Organization regions. Gastroenterology. 2018 Nov 1;155(5):1372-1382.e17.
24. Vilaichone RK, Quach DT, Yamaoka Y, Sugano K, Mahachai V. Prevalence and pattern of antibiotic resistant strains of Helicobacter pylori infection in ASEAN. Asian Pac J Cancer Prev. 2018 May 26;19(5):1411–3.
25. Kiyotoki S, Nishikawa J, Sakaida I. Efficacy of vonoprazan for Helicobacter pylori eradication. Intern Med Tokyo Jpn. 2020 Jan 15;59(2):153–61.
26. McNicholl AG, Bordin DS, Lucendo A, Fadeenko G, Fernandez MC, Voynovan I, et al. Combination of bismuth and standard triple therapy eradicates Helicobacter pylori infection in more than 90% of patients. Clin Gastroenterol Hepatol. 2020 Jan;18(1):89–98.
27. Dinis-Ribeiro M, Areia M, de Vries AC, Marcos-Pinto R, Monteiro-Soares M, O’Connor A, et al. Management of precancerous conditions and lesions in the stomach (MAPS): guideline from the European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter Study Group (EHSG), European Society of Pathology (ESP), and the Sociedade Portuguesa de Endoscopia Digestiva (SPED). Endoscopy. 2012 Jan;44(1):74–94.
28. Nyssen OP, Bordin D, Tepes B, Pérez-Aisa Á, Vaira D, Caldas M, et al. European Registry on Helicobacter pylori management (Hp-EuReg): patterns and trends in first-line empirical eradication prescription and outcomes of 5 years and 21 533 patients. Gut. 2021 Jan;70(1):40–54
Рекомендуемые статьи
Синдром Бейфорда
сдавление пищевода аномальной подключичной артерией сопровождающееся дисфагией.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.

















.jpg)




.png)















Комментарии