- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: ПЛЮСЫ И МИНУСЫ ПРИМЕНЕНИЯ СТЕНТА ДАНИША ПРИ ПИЩЕВОДНОМ КРОВОТЕЧЕНИИ
| Авторы: | Андрей Юрьевич Анисимов 1 Александр Викторович Логинов 2 Андрей Андреевич Анисимов 3 Магомед Нухкадиевич Насруллаев1 4 2016г. |
| Об авторах: |
1. 1Казанская государственная медицинская академия, г. Казань, Россия; 2. Городская клиническая больница №7, г. Казань, Россия 3. Казанский государственный медицинский университет, г. Казань, Россия 4. Казанская государственная медицинская академия, г. Казань, Россия |
Анонс:
Критический анализ мирового клинического опыта эндоскопического гемостаза саморасширяющимися нитиноловыми стентами Даниша при острых кровотечениях из варикозно расширенных вен пищевода.
Преимущества стента Даниша:
- · малая травматичность,
- · хорошая переносимость пациентом,
- · обеспечение физиологического дренажа слюны и возможности приёма жидкости и пищи через рот,
- · возможность повторного эндоскопического осмотра пищевода и желудка после введения стента,
- · уменьшение риска аспирационной пневмонии,
- · невозможность удаления или смещения самим пациентом в состоянии психомоторного возбуждения.
По мнению большинства авторов, стент Даниша позволяет выиграть время для подготовки к безопасному трансъюгулярному интрапечёночному портокавальному шунтированию, хирургическим вмешательствам или даже трансплантации печени. Это время должно быть использовано для выполнения всех процедур, необходимых для стабилизации состояния пациента и уточнения характера имеющейся патологии.
К недостаткам следует отнести
- · высокий риск спонтанной миграции из пищевода в просвет желудка с потерей стентом тампонирующей функции,
- · ограничение лечебного эффекта только варикозно расширенными венами пищевода,
- · развитие мелких эрозий или язв на слизистой оболочке пищевода после удаления стента.
Если стент Даниша использовали в качестве окончательного метода лечения у пациентов, непригодных для трансъюгулярного интрапечёночного портокавального шунтирования или пересадки печени, то показатели смертности достигали 50%.


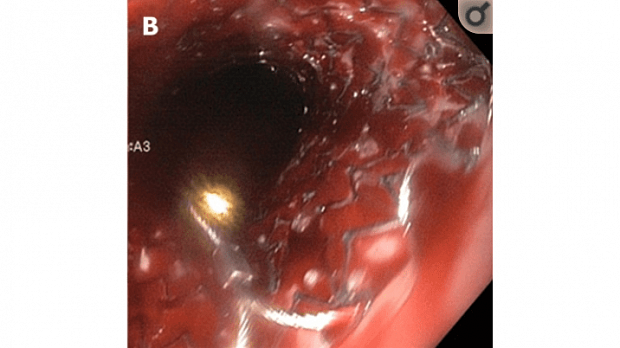


Полный текст статьи:
Вам может быть интересно:

- Что такое стент Даниша. Показания. Брошюра. Видео.
- МосЭндО Алгоритм ведения больных при кровотечении из варикозных вен пищевода и желудка
- Варикозное расширение вен пищевода. Всемирная Гастроэнтерологическая Организация, 2014 г.
- Лигирование варикозно расширенных вен пищевода (ВРВП) Лекция К.В. Шишин
- Обзор литературы: ПОРТАЛЬНАЯ ГИПЕРТЕНЗИВНАЯ ГАСТРОПАТИЯ ПГГ 2018
- Гастропатия при портальной гипертензии
- РОЛЬ ЛИГИРОВАНИЯ ВАРИКОЗНО-РАСШИРЕННЫХ ВЕН ПИЩЕВОДА В ПРОФИЛАКТИКЕ КРОВОТЕЧЕНИЙ ПОРТАЛЬНОГО ГЕНЕЗА
- Практические рекомендации по лечению кровотечений из варикозно расширенных вен пищевода и желудка
1Казанская государственная медицинская академия, г. Казань, Россия;
2Городская клиническая больница №7, г. Казань, Россия;
3Казанский государственный медицинский университет, г. Казань, Россия
Реферат DOI: 10.17750/KMJ2016-918
цель. Критический анализ мирового клинического опыта эндоскопического гемостаза саморасширяющимися нитиноловыми стентами Даниша при острых кровотечениях из варикозно расширенных вен пищевода.
методы. Проанализированы литературные данные последних 10 лет о применении саморасширяющихся нитиноловых стентов Даниша на высоте пищеводного кровотечения или при высоком риске рецидива последнего.
Результаты. Преимущества стента Даниша — малая травматичность, хорошая переносимость пациентом, обеспечение физиологического дренажа слюны и возможности приёма жидкости и пищи через рот, возможность повторного эндоскопического осмотра пищевода и желудка после введения стента, уменьшение риска аспирационной пневмонии, невозможность удаления или смещения самим пациентом в состоянии психомоторного возбуждения. По мнению большинства авторов, стент Даниша позволяет выиграть время для подготовки к безопасному трансъюгулярному интрапечёночному портокавальному шунтированию, хирургическим вмешательствам или даже трансплантации печени. Это время должно быть использовано для выполнения всех процедур, необходимых для стабилизации состояния пациента и уточнения характера имеющейся патологии. К недостаткам следует отнести высокий риск спонтанной миграции из пищевода в просвет желудка с потерей стентом тампонирующей функции, ограничение лечебного эффекта только варикозно расширенными венами пищевода, развитие мелких эрозий или язв на слизистой оболочке пищевода после удаления стента. Если стент Даниша использовали в качестве окончательного метода лечения у пациентов, непригодных для трансъюгулярного интрапечёночного портокавального шунтирования или пересадки печени, то показатели смертности достигали 50%.
Вывод. На сегодняшний день нет окончательной ясности, насколько прочное место в алгоритме лечения больных с варикозными кровотечениями займёт эндоскопический гемостаз саморасширяющимися нитиноловыми стентами Даниша; необходимо подтверждение первоначальных положительных клинических результатов в дальнейших сравнительных рандомизированных контролируемых исследованиях.
Ключевые слова: портальная гипертензия, кровотечение, варикозно расширенные вены, вены пищевода, эндоскопический гемостаз, стент Даниша, зонд-обтуратор Сенгстакена–Блэкмора.
PROS AND CONS Of DANIS STENT APPLICATION IN ESOPHAGEAL bLEEDING
A.Yu. Anisimov1,2, A.V. Loginov 2, A.A. Anisimov3, M.N. Nasrullaev1 1Kazan State Medical Academy, Kazan, Russia;
2City clinical hospital №7, Kazan, Russia;
3Kazan State Medical University, Kazan, Russia
Aim. A critical analysis of world clinical experience of endoscopic hemostasis with self-expanding nitinol Danis stents application in acute bleeding from esophageal varices.
Methods. Literature data of last 10 years about self-expanding nitinol Danis stents application at the peak of esophageal bleeding or in high risk of its recurrence were analyzed.
Results. The advantages of Danis stent include minimal injury, good tolerance by the patient, providing physiological drainage of saliva and the possibility of fluid and food intake through the mouth, possibility of a repeated endoscopic inspection of the esophagus and stomach after the application of the stent, reducing the risk of aspiration pneumonia, the impossibility of removal or displacement by the patient in agitation. According to most authors, Danis stent allows saving time to get ready for safe transjugular intrahepatic portocaval shunt (TIPS), surgical intervention or liver transplantation. This time should be used for performing all procedures necessary to stabilize the patient’s condition and clarify the nature of the existing pathology. Disadvantages include high risk of migration from the esophagus into the stomach with loss of its plugging function, limitation for treatment of only esophageal varices, development of small erosions or ulcers on the mucous membrane of the esophagus after removal of the stent. When Danis stent was used as a final method of treatment in patients who do not fit for TIPS or liver transplant, the mortality rate reached 50%.
Conclusion. To date, it is not yet clarified whether endoscopic hemostasis with self-expanding nitinol Danis stents should be firmly used in the treatment algorithm of patients with variceal bleeding; confirmation of initial clinical results in further comparative randomized controlled trials is necessary.
Keywords: portal hypertension, bleeding, esophageal varices, endoscopic hemostasis, Danis stent, Sengstaken– Blakemore tube.
Любому специалисту, имеющему дело с пациентами, страдающими портальной гипертензией (ПГ), известно о катастрофическом положении больного с массивным кровотечением из варикозно расширенных вен (ВРВ) пищевода, которое в 20% наблюдений не может быть остановлено с помощью стандартной лечебной программы, базирующейся на сочетании медикаментозной терапии и интервенционных процедур в виде эндоскопического лигирования или склерозирования ВРВ [2, 3, 6].
Баллонная тампонада зондом-обтуратором Сенгстакена–Блэкмора (Sengstaken–Blakemore) обеспечивает достижение гемостаза в 60–90% случаев. С другой стороны, неправильное использование зонда-обтуратора Сенгстакена– Блэкмора влечёт за собой ряд тяжёлых осложнений, таких как некроз или разрыв пищевода и аспирационная пневмония, в 10–15% случаев. Именно поэтому сроки нахождения зонда-обтуратора в пищеводе ограничены и не должны превышать 12–24 ч. Кроме того, в 50% случаев после удаления зонда-обтуратора Сенгстакена– Блэкмора риск повторных кровотечений бывает относительно высоким [11, 14, 25].
Идея использования экспансивной силы саморасширяющегося металлического стента для пережатия кровоточащего варикозного узла с целью прекращения кровотечения возникла на рубеже XX и XXI веков в Австрии. В ноябре 2002 г. Ян Даниш попытался остановить кровотечение из ВРВ пищевода у 27-летнего мужчины, страдавшего ПГ в исходе хронического вирусного гепатита С и ВИЧ-инфекции, перенёсшего за 3 года до этого трансплантацию печени, осложнённую тяжёлой коагулопатией, путём имплантации саморасширяющегося металлического стента. Кровотечение было остановлено, а стент после стабилизации клинической ситуации был удалён из пищевода через несколько дней [28, 29]. Это послужило началом использования саморасширяющихся металлических стентов, ранее применявшихся при лечении злокачественных пищеводных стенозов, перфораций пищевода и трахеопищеводных свищей, для остановки кровотечения из ВРВ пищевода у больных ПГ [8, 23, 41, 43].
После испытания стентов в экспериментальных моделях на животных были усовершенствованы их технические характеристики, и сегодня стенты, предназначенные для эндоскопического гемостаза, носят имя Даниша [22, 27, 42].
Показания к применению стента Даниша. Немногочисленные литературные данные, существующие на сегодняшний день, позволяют говорить о том, что стент Даниша очень эффективен в остановке пищеводного варикозного кровотечения [17, 18, 21, 35]. Кроме того, стент Даниша может быть использован для остановки кровотечений из язв слизистой оболочки пищевода после предшествовавшего лигирования или склеротерапии, когда стандартное эндоскопическое лечение часто неэффективно [13].
Противопоказания к применению стента Даниша. Для правильного терапевтического применения стента точное местонахождение источника кровотечения имеет решающее значение. Эффективная остановка кровотечения из варикозных узлов с помощью пищеводного стента возможна только при локализации источника кровотечения в пищеводе. Случаи неэффективного гемостаза обычно связаны с локализацией источника кровотечения в другом месте [41].
Проблематичная ситуация возникает у больных с большими грыжами пищеводного отверстия диафрагмы. Последние считают относительным противопоказанием к установке стента Даниша. Дело в том, что в этой ситуации существует риск, с одной стороны, недостаточного пережатия кровоточащих варикозных узлов в пищеводе, а с другой стороны — миграции стента [37].
Проблемы также могут возникнуть у пациентов с анатомически более коротким или более длинным пищеводом.
В первом случае проксимальный конец стента может сдавить левый бронх, что приведёт к развитию острой дыхательной недостаточности.
Во втором случае источник кровотечения в пищеводе может располагаться относительно высоко, и проксимальный конец стента не сможет его перекрыть. Эта проблема может быть решена при повторной контрольной эндоскопии потягиванием стента на себя таким образом, чтобы дистальный конец стента оказался в кардии или чуть выше. Однако в этом случае существует более высокий риск изъязвления варикозного узла в области желудочно-пищеводного соединения [37].
Результаты применения стента Даниша. В 2004 г. группа авторов из Австрии впервые опубликовала собственный клинический опыт использования пищеводных стентов для остановки кровотечения из ВРВ у 6 пациентов с декомпенсированным (класс С по Child–Pugh) циррозом печени (ЦП) [28].
Стент Даниша был установлен только в 1 случае. В остальных 5 случаях применили пищеводные стенты, предназначенные для лечения злокачественных новообразований пищевода. И тем не менее, у всех 6 пациентов установка стентов в пищевод позволила остановить кровотечение с последующей стабилизацией гемодинамики.
Стенты были удалены через 5 сут. При этом ни в одном из наблюдений непосредственно после удаления стента рецидива кровотечения не последовало. Ни в одном случае авторы не наблюдали каких-либо осложнений, связанных с установкой или извлечением стентов.
После стабилизации состояния далее по отношению к 2 пациентам был применён рентгеноэндоваскулярный метод: трансъюгулярное интрапечёночное портокавальное шунтирование (TIPS — от англ. Transjugular Interhepatic Portosystemic Shunt). У 2 пациентов были выполнены операции азигопортального разобщения, у 1 больного — трансплантация печени. В 1 наблюдении эрадикация ВРВ пищевода была достигнута сочетанием эндоскопического лигирования и вазоактивной медикаментозной терапии β-адреноблокаторами.
Фактически это была первая публикация, продемонстрировавшая эффективность пищеводных стентов для остановки пищеводного кровотечения. Однако число наблюдений было очень невелико.
В 2006 и 2008 гг. эти же авторы опубликовали свои результаты лечения в общей сложности 34 больных с острыми пищеводными кровотечениями установкой в пищевод саморасширяющихся металлических стентов [29, 43]. У всех пациентов причиной ПГ был ЦП, в том числе у 13 — субкомпенсированный (класс В по Child– Pugh), у 21 — декомпенсированный (класс С по Child–Pugh). У всех эндоскопически был подтверждён диагноз продолжающегося кровотечения из ВРВ пищевода.
Авторы не отметили никаких осложнений во время установки стентов. Имплантация стента в пищевод позволила остановить кровотечение у 33 больных.
В 1 наблюдении через 4 ч после установки стента возник рецидив кровотечения. Однако его источником была язва желудка, что потребовало тотальной гастрэктомии и азигопортального разобщения. У 7 пациентов стенты мигрировали дистальнее, однако с помощью эндоскопа было восстановлено их правильное положение. Время нахождения стентов в пищеводе варьировало от 1 до 14 сут, в среднем составляя 5 сут.
После удаления стента у 1 пациента было обнаружено небольшое изъязвление слизистой оболочки пищевода в проекции нахождения дистального конца стента.
Достигнутый с помощью стентов эндоскопический гемостаз позволил в дальнейшем продолжить терапию ПГ, в том числе применить TIPS, эндоскопическое лигирование, рентгеноэндоваскулярную эмболизацию сосудов или хирургическую коррекцию.
Умер 21 (61,8%) больной, в том числе 2 (5,9%) — в течение 24 ч после установки стента, 9 (26,5%) — в течение 30 сут, 10 (29,4%) — в течение 60 сут после удаления стента. Во всех случаях причиной смерти была полиорганная и печёночная недостаточность при стабильном гемостазе [29, 43].
В 2009 г. на конференции Gastro 2009 — UEGW/WCOG Conference в Лондоне в виде постера было опубликовано сообщение группы авторов из Дании [8] об использовании саморасширяющихся металлических стентов у 7 пациентов с массивным пищеводным кровотечением. У всех больных с помощью установки стен тов в пищевод был получен стабильный гемостаз. Дистальная миграция стентов произошла в 2 случаях. Однако при этом рецидива кровотечения не было, и эндоскопически стенты были возвращены в правильное положение. Стенты удаляли в диапазоне от 4 до 22 сут (в среднем через 9,7 сут). У 2 пациенток после удаления стента возник рецидив кровотечения, который был остановлен повторной установкой нового стента. После удаления второго стента кровотечение больше не возобновлялось.
В 2010 г. группа авторов из Лондона [41] поделилась своим опытом использования стента Даниша у 10 пациентов с пищеводными кровотечениями, которые продолжались, несмотря на проводимые в соответствии с рекомендациями Baveno IV эндоскопические вмешательства и медикаментозную терапию. Эти пациенты имели противопоказания к TIPS, в том числе из-за наличия гепатоцеллюлярной карциномы у 2 больных. У 2 пациентов выбор стента был связан с наличием разрыва пищевода, вызванного зондом-обтуратором Сенгстакена–Блэкмора.
Установка стента у 8 больных прошла без каких-либо осложнений. У 1 пациента потребовалась замена стента на новый. У 1 больного установить стент в пищевод не удалось. Кровотечение было остановлено с помощью стента в 7 из 9 успешных размещений. В 2 случаях источником продолжающегося кровотечения были варикозные вены желудка. В одном из них стент был установлен в пищевод без предварительной эндоскопической верификации источника кровотечения из-за тяжести состояния пациента, во втором случае эндоскопия была выполнена, но найти источник сильного кровотечения в желудке не удалось. В обоих случаях гемостаз был достигнут аппликациями гистоакрилового клея. Положение стента в пищеводе ежедневно контролировали на рентгенограммах грудной клетки. Стенты удаляли в диапазоне от 6 до 14 сут (в среднем на 9-е сутки) без каких либо осложнений. Только 1 пациент имел изъязвления пищевода в месте расположения проксимального конца стента.
Умерли 4 пациента. 3 (30%) пациента погибли в течение 5 сут от начала кровотечения: 1 — от полиорганной недостаточности, 2 — от кровопотери. На 11-е и 17-е сутки после удаления стента при стабильном гемостазе 2 пациента умерли от полиорганной недостаточности. У 1 пациента через 60 сут после удаления стента возник рецидив кровотечения. 2 больным с разрывом пищевода после использования зонда-обтуратора Сенгстакена–Блэкмора ещё до извлечения стента было выполнено TIPS. Ни у одного из них рецидива кровотечения не было.
В 2011 г. чешские авторы [23] опубликовали клинический случай наблюдения за пациенткой с аутоиммунным гепатитом, поставленной в лист ожидания для пересадки печени. При поступлении в отделение интенсивной терапии у неё развилось массивное кровотечение из ВРВ пищевода, которое не удалось остановить эндоскопически. Установка стента Даниша в пищевод привела к остановке кровотечения. Через 10 сут после стентирования была выполнена пересадка печени. На 3-й день после трансплантации стент был удалён. При этом на слизистой оболочке пищевода были отмечены лишь небольшие эрозии.
В 2012 г. немецкие авторы [14] сообщили о результатах стентирования у 8 пациентов с продолжающимся активным кровотечением из ВРВ пищевода. Все больные имели декомпенсированный (стадия С по Child–Pugh) ЦП с индексом MELD в среднем 29,3. У всех пациентов после установки стента Даниша кровотечение сразу же остановилось. Это было подтверждено эндоскопически.
У 1 пациента возникло острое нарушение параметров внешнего дыхания вследствие частичного сдавления стентом левого главного бронха. Это было подтверждено при бронхоскопии и компьютерной томографии грудной клетки. Стент был немедленно удалён, и параметры вентиляции улучшились.
Стенты удаляли на сроке от 7 до 14 сут, в среднем через 11 сут. У 1 пациента во время удаления стент был захвачен эндоскопическими щипцами и извлечён без втягивания в экстрактор. Это было связано с тем, что на обоих концах стента оторвались петли для удаления. Сразу же после удаления рецидивов кровотечения не наблюдали.
После удаления стента 1 пациент умер через 5 сут от печёночной недостаточности. 1 пациенту было проведено трансъюгулярное внутрипечёночное портосистемное шунтирование (TIPS), 1 больной был поставлен в лист ожидания для трансплантации печени. 5 пациентам с противопоказаниями к TIPS, трансплантации или другим вариантам хирургической коррекции проводили консервативную терапию β-адреноблокаторами и нитратами. У 3 из этих 5 человек рецидив кровотечения возник на 1-е, 2-е и 9-е сутки после удаления стента.
В 2012 г. авторы из Молдавии [25] поделились своим опытом. В анализ вошли 14 пациентов с ЦП и пищеводным кровотечением, в том числе 9 — с ВРВ пищевода, 5 — с изъязвлением после эндоскопического лигирования. Средний возраст пациентов составил 51,1 года, средний балл по шкале Child–Pugh был 9,5, по шкале MELD — 17,6.
По данным авторов, установка стентов во всех наблюдениях прошла успешно, без каких либо осложнений. В то же время соотношение пациент/стент составило 1/1,25 (диапазон 1–3) стента на 1 пациента. В связи с этим можно предположить, что части пациентов в процессе установки потребовалось более одного стента. Вероятно, это можно объяснить возникновением во время установки каких-либо осложнений, потребовавших замены стента на новый.
Среднее время установки стента составило 4 мин 47 с. Во всех наблюдениях был достигнут надёжный гемостаз. Дистальная миграция стента произошла в 5 случаях. Авторы не упоминают о рецидивах кровотечения, связанных с дислокациями стентов, либо об осложнениях во время нахождения стентов в пищеводе.
Стенты удаляли в сроки от 0,8 до 7 сут (в среднем через 3,9 сут). Рецидивов кровотечения сразу после удаления стентов не было ни в одном клиническом наблюдении. В течение 30 сут после удаления стентов умерли 5 (35,7%) больных. Причинами смерти стала печёночная недостаточность у 3 больных, геморрагический инсульт — у 1, рецидив кровотечения из ВРВ пищевода в дистальном направлении от места расположения дистального конца стента — у 1 пациента.
В 2013 г. группа авторов из Египта [42] опубликовала свой опыт работы по установке стента Даниша у 16 пациентов с ЦП, в том числе компенсированным (стадия А по Child–Pugh) — у 2 (12,5%), субкомпенсированным (стадия В по Child–Pugh) — у 8 (50%), декомпенсированным (стадия С по Child–Pugh) — у 6 (37,5%) больных. Стенты были успешно размещены в 15 случаях. В 1 наблюдении стент не удалось установить из-за разрыва желудочного баллона во время установки. В качестве альтернативы пациенту была выполнена склеротерапия. В 1 случае в связи с технической неисправностью доставочного устройства авторы вынуждены были установить новый стент без каких-либо осложнений. В 1 случае сразу же после установки произошла миграция стента в желудок. С помощью эндоскопа стент был втянут в пищевод и установлен в стандартную позицию.
Кровотечение было остановлено в 14 случаях. В 1 наблюдении не удалось добиться гемостаза в связи с миграцией стента в желудок. Ещё в 1 наблюдении источник кровотечения располагался в области гастроэзофагеального перехода, вне зоны воздействия стента. В этой ситуации авторы вынуждены были прибегнуть к эндоскопическому склерозированию кровоточащего варикозного узла.
В 6 наблюдениях стенты мигрировали: дистально в желудок — у 5 больных, проксимально по пищеводу — у 1 больного. Однако ни в одном из этих наблюдений рецидива кровотечения не было.
Стенты удаляли на сроках от 2 до 4 сут. После удаления на слизистой оболочке пищевода имели место многочисленные мелкие изъязвления, в том числе в 1 случае — глубокая язва.
Умерли 4 (25%) больных, в том числе 1 пациент — на высоте продолжающегося кровотечения из варикозного узла в области гастроэзофагеального перехода, 3 больных — на фоне прогрессирующей полиорганной недостаточности при стабильном гемостазе.
В 2013 г. группа авторов из Голландии [27] сообщила о 5 случаях стентирования: у 1 пациента с метастазами в печень опухоли толстой кишки и у 4 больных ЦП со средним индексом MELD=20. У всех 5 пациентов были профузные кровотечения из ВРВ пищевода и противопоказания для применения TIPS.
Установка стентов у всех 5 больных прошла без осложнений. Непосредственно после установки стентов гемостаз был достигнут во всех наблюдениях.
У 1 больного на 7-й день после установки развился рецидив кровотечения из варикозного узла, расположенного над проксимальным концом стента, который при этом находился в правильном положении. Кровотечение было остановлено методом рентгеноэндоваскулярной эмболизации желудочных вен. Однако, несмотря на повторно достигнутый гемостаз, пациент умер через 6 сут.
Дистальное смещение стента произошло у 1 пациента, однако кровотечение при этом не возобновилось. У 2 больных стенты удалили через 14 и 17 сут после установки. 2 пациента умерли до удаления стентов. У 1 больного с метастазами в печень опухоли толстой кишки стент специально не удаляли до смерти, которая наступила через 7 мес после установки. При этом перфорации или смещения стента не было. В 2013 г. группа авторов из Швейцарии [22] поделилась опытом применения стента Даниша в 9 клинических наблюдениях. Успешно установить стент в пищевод удалось в 8 (89%) наблюдениях. В чём была причина неудачи у 1 пациента — в работе не указано.
Во всех случаях успешной имплантации стента был достигнут первичный гемостаз. Дистальная миграция стента произошла в 2 случаях, однако из текста неясно, привело это к рецидиву кровотечения или нет. Стенты удалили только у 3 пациентов в сроки от 1 до 5 сут, в среднем через 3 сут после установки. Рецидива кровотечения не было ни у одного пациента во время нахождения стентов в пищеводе. В течение 5 сут умерли 5 человек, в течение 6 нед — ещё 2 пациента. В работе нет информации о причинах смерти.
В 2011 г. Д.Н. Трофимов из Чебоксар [4] сообщил об установке 2 стентов Даниша.
Первый стент был установлен пациенту 45 лет с диагнозом «Алкогольный ЦП, асцит, острое кровотечение из ВРВ пищевода». Установка зонда-обтуратора Сенгстакена–Блэкмора дала временную остановку кровотечения, однако после парентерального питания и введения растворов с целью нормализации артериального давления и гомеостаза возникло повторное профузное кровотечение.
Было принято решение установить саморасправляющийся металлический стент Даниша. После установки стента была сразу отмечена остановка кровотечения.
В дальнейшем произошло смещение стента в желудок с развитием повторного кровотечения. Была произведена репозиция стента с повторной установкой в пищевод. Причём дистальный край был установлен ровно на уровне кардиальной розетки. Был достигнут гемостаз.
На 21-й день после установки стента было проведено его удаление при помощи экстрактора. Удаление прошло без осложнений. На месте нахождения стента были отмечены следы сетчатого вдавления, над проксимальным краем — отёк слизистой оболочки, точечные геморрагии и эрозии. На следующий день больной был выписан домой.
За 6 мес наблюдения больному 3 раза проводили контрольную эзофагогастроскопию. Случаев повторного кровотечения из ВРВ пищевода не отмечено.
Второй больной находился в состоянии печёночной комы, диагноз: «ЦП в исходе алкогольной болезни печени. Асцит. Повторное кровотечение из ВРВ пищевода». Больному был введён зонд-обтуратор Сенгстакена–Блэкмора, но добиться гемостаза не удалось. При продолжающемся профузном кровотечении была проведена установка металлического стента Даниша. Через 30 мин было отмечено значительное уменьшение интенсивности кровотечения из ВРВ пищевода. Однако больной продолжал оставаться в состоянии печёночной комы, у него развились синдром диссеминированного внутрисосудистого свёртывания, желудочное и кишечное кровотечение. Через сутки на фоне нарастающей печёночной недостаточности больной скончался.
Первое сравнительное многоцентровое рандомизированное контролируемое исследование по оценке эффективности эндоскопического гемостаза при пищеводных кровотечениях саморасширяющимися металлическими стентами и баллонной тампонадой зондом-обтуратором Сенгстакена–Блэкмора было проведено авторами из Барселоны в восьми университетских больницах Испании. Результаты были представлены на 64-й ежегодной конференции Американской ассоциации по изучению заболеваний печени (AASLD) в Вашингтоне в 2013 г. [18].
На основе рандомизации в группу сравнения с баллонной тампонадой зондом-обтуратором Сенгстакена–Блэкмора были включены 15 пациентов, в основную группу с саморасширяющимся металлическим стентом Даниша — 13 пациентов. Условием эффективности терапии было определено выживание в течение 15 сут на фоне гемостаза и без возникновения серьёзных осложнений.
Успех был достигнут в основной группе в 46% случаев, в группе сравнения — в 13% (р=0,055). Кроме того, основная группа показала лучший гемостаз — 77% против 47% (р=0,10), более низкие показатели числа переливаний крови — 3±3,4 против 6±4,8 единицы крови (р=0,08), а также более низкий уровень серьёзных осложнений — 31% против 67% (р=0,058) в группе сравнения.
Выживаемость через 15 сут составила 61% в основной группе против 47% в группе сравнения (р=0,4).
Серьёзными осложнениями были аспирационная пневмония (2 против 8 случаев), сердечная недостаточность (по 1 случаю в каждой группе), разрыв пищевода (1 случай в группе сравнения), гепаторенальный синдром (1 случай в основной группе).
Авторы пришли к выводу, что для временной остановки кровотечения из ВРВ пищевода саморасширяющийся металлический стент Даниша был более эффективен, чем зонд-обтуратор Сенгстакена–Блэкмора.
Случай применения стента Даниша для остановки кровотечения из язв пищевода, образовавшихся после лигирования ВРВ, приведён в работе I. Mishin и соавт. [32]. У пациента с декомпенсированным (стадия С по Child–Pugh) ЦП и кровотечением на высоте продолжающегося пищеводного кровотечения из ВРВ пищевода было выполнено лигирование. Через 9 сут возник рецидив массивного кровотечения, источником которого стала язва на месте ранее лигированного варикса. Кроме того, в пищеводе было еще семь некровоточащих язв. На этот раз гемостаз был достигнут установкой стента Даниша. Стент был удалён через 8 дней. В дальнейшем кровотечение не возобновлялось, и пациент был выписан из больницы.
В 2008 году W.-R. Matull и соавт. описали случай использования стента Даниша для местного лечения комбинации кровотечения из ВРВ пищевода и разрыва пищевода после использования зонда-обтуратора Сенгстакена–Блэкмора [30].
Во время эндоскопии у пациента были обнаружены варикоз и разрыв слизистой оболочки пищевода длинной 12 см на расстоянии от 28 до 40 см от резцов. Происхождение разрыва связано с нагнетанием воздуха в баллоны зонда-обтуратора Сенгстакена–Блэкмора, который перед этим был помещён в пищевод с целью гемостаза. Компьютерная томография показала присутствие воздуха в средостении.
Пациенту был установлен стент Даниша. Через 36 ч пациенту было выполнено TIPS. Стент Даниша был удалён через 7 сут. Никаких других осложнений больше не было. На 13-е сутки после стентирования пациент был выписан.
Стенты также широко упоминаются в нескольких обзорах [17, 20, 21, 31, 35, 40]. В ряде публикаций о них пишут лишь вскользь [7, 10, 12, 33, 36, 38]. Использование стента уже включе-
но в некоторые рекомендации [9, 15, 34]. Статьи по стенту Даниша можно встретить и не в англоязычной медицинской литературе [24, 26, 39].
За период с июня 2015 г. по май 2016 г. мы приобрели клинический опыт лечения 17 пациентов на высоте пищеводного кровотечения или с высоким риском рецидива последнего, в комплексной лечебной программе которых для обеспечения эндоскопического гемостаза вместо традиционной баллонной тампонады зондомобтуратором Сенгстакена–Блэкмора были использованы саморасширяющиеся нитиноловые стенты Даниша («SX — Ella Danis») производства ELLA-CS (Чешская республика).
Среди наблюдаемых нами больных были 7 (41,2%) мужчин и 10 (58,8%) женщин. В возрасте от 15 до 39 лет были 6 (35,3%) пациентов, от 40 до 59 лет — 9 (52,9%), 60 лет и старше — 2 (11,8%) человека.
У 13 (76,5%) пациентов были обнаружены ВРВ пищевода, у 4 (23,5%) — ВРВ пищевода и кардиального отдела желудка. Из 13 больных с ВРВ пищевода у 10 (76,9%) они локализовались в нижней его трети, у 3 (23,1%) — в средней и нижней третях. В 2 (15,4%) случаях была обнаружена II степень, в 11 (84,6%) — III степень варикозной трансформации вен пищевода [5]. У 1 (5,9%) пациента была кровопотеря лёгкой, у 7 (41,2%) — средней, у 9 (52,9%) — тяжёлой степени [1].
В связи с отсутствием клинического опыта на начальных этапах освоения методики во всех 17 клинических наблюдениях мы выполняли эндоскопический контроль правильности нахождения стента в пищеводе сразу же после окончания процедуры его установки.
Из 17 установленных по инструкции производителя стентов 5 (33,3%) мигрировали в желудок, при этом 1 стент не раскрылся вообще, 4 мигрировали уже в расправленном виде. Мы связываем этот факт с недостатком опыта при установке стентов на начальных этапах освоения методики. 12 (70,6%) стентов были успешно установлены без каких-либо осложнений в стандартную позицию в пищевод. Это было подтверждено эндоскопически сразу же после извлечения доставочного устройства.
У 13 пациентов на 3–7-е сутки после установки удалили стенты с помощью фиброгастродуоденоскопа под стандартной местной анестезией ротоглотки 2–3 дозами спрея Lidocaini 10%. При этом у 9 (69,2%) пациентов для извлечения использовали стандартный ELLAэкстрактор производства ELLA-CS (Чешская республика), а у 4 (30,8%) ввиду отсутствия ELLA-экстрактора — эндоскоп. Из 17 пациентов 5 (29,4%) скончались, несмотря на достигнутый эндоскопический гемостаз, на фоне прогрессирующей полиорганной недостаточности.
Мероприятия после применения стента Даниша. Наилучшие результаты выживаемости были достигнуты в том случае, когда стент Даниша использовали в качестве «моста» к окончательной терапии (TIPS или в небольшом количестве случаев трансплантации печени). Если же стент Даниша применяли в качестве окончательного метода лечения у пациентов, непригодных для TIPS или пересадки печени, то показатели смертности достигали 50%.
По мнению большинства авторов, стент Даниша позволяет выиграть время для подготовки к безопасному TIPS, хирургическим вмешательствам или даже трансплантации печени. Это время должно быть использовано для выполнения всех процедур, необходимых для стабилизации состояния пациента и уточнения характера имеющейся патологии.
На сегодняшний день нет окончательной ясности в том, насколько прочное место в алгоритме лечения больных с кровотечениями из ВРВ пищевода займёт эндоскопический гемостаз саморасширяющимися нитиноловыми стентами Даниша. Так, например, данные А. Escorsell и соавт. [19] не подтверждают преимуществ стентирования пищевода перед его баллонной тампонадой зондом-обтуратором Сенгстакена– Блэкмора.
Не случайно в рекомендациях Baveno VI Consensus Workshop эндоскопический гемостаз саморасширяющимися нитиноловыми стентами Даниша рассматривают в качестве привлекательной альтернативы баллонной тампонаде зондами-обтураторами Сенгстакена–Блэкмора, но в то же время указывают на необходимость подтверждения первоначальных клинических результатов в дальнейших сравнительных рандомизированных контролируемых исследованиях [16].
Таким образом, эти и многие другие аспекты использования саморасширяющихся нитиноловых стентов Даниша в комплексной лечебной программе больных с кровотечениями из ВРВ пищевода требуют дальнейшего углублённого всестороннего изучения и научно-практических шагов в разработке оптимальных режимов лечебной программы при данной патологии.
Список литературы:
Статьи по теме
Рекомендуемые статьи
Синдром Бурхаве
Спонтанный разрыв пищевода - характеризуется спонтанным разрывом всех слоев стенки пищевода. Первое описание данного состояния дано голландским врачом Германом Бурхаве (Hermann Boerhaave) в 1724 г.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.














.jpg)





.png)



.jpg)
.jpg)














Комментарии