- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Семейный аденоматозный полипоз: симптомы, генетика
Анонс:
- Синдром Гарднера
- Синдром Тюрко

Полный текст статьи:
Аникина М.С., врач-эндоскопист ГБУЗ НСО «Государственная Новосибирская областная клиническая больница», 2018 год
Семейный аденоматозный полипоз толстой кишки (САП, синонимы: диффузный семейный полипоз, болезнь Schmieden — Westhues) — аутосомно-доминантное заболевание, причиной которого является герминальная мутация гена APC (Adenomatous polyposis coli), приводящая к развитию множества (>100) тубулярных и тубулярно-ворсинчатых аденом в толстой кишке с микроаденомами между ними и их 100-процентной прогрессии в колоректальный рак (КРР) в молодом возрасте. При данном заболевании можно наблюдать образование полипов в верхних отделах желудочно-кишечного тракта, десмоидов и других внекишечных новообразований.
САП относится к так называемым генетически обусловленным мультиопухолевым синдромам, которые представляют собой отдельную группу заболеваний, характеризующихся развитием неоплазий желудочно-кишечного тракта с высоким риском развития онкозаболеваний, в том числе и внекишечной локализации. В эту группу наряду с САП входят синдром Пейтца — Егерса, синдром Кауден, ювенильный полипоз, наследственный синдром смешанного полипоза, синдром Банаяна — Райли — Рувалькабы, при которых частота и локализация аденоматозных или гамартомных полипов у пораженных пациентов значительно варьирует. Риск развития рака различных отделов желудочно-кишечного тракта и других органов также различается. Эти синдромы могут быть условно разделены на аденоматозные и гамартомные. Многие клиницисты не придают большого значения наследственным факторам при оценке вероятности развития рака, и члены семьи, как правило, также не знают о наличии такой опасности. Но при этом клиническое распознавание данных синдромов необходимо не только из-за высокого риска смертности от малигнизации полипов, что составляет до 1% КРР, но также из-за угрозы развития специфически ассоциированных внекишечных неоплазий, которые у пациентов в течение жизни манифестируют в разном возрасте. Кроме того, для носителей этих синдромов клиническое течение заболевания может сопровождаться опасными осложнениями, такими как кровотечение, инвагинация, обструкция кишечника. В настоящее время возможно проведение генетического тестирования, позволяющего выявить семьи — носители герминальных мутаций генов, предрасполагающих к специфически ассоциированным неоплазиям, что дает возможность назначить адекватный клинический скрининг и необходимое лечение, которые во многих случаях значительно отличаются от рекомендаций для общей популяции [1–5, 7].
Эпидемиология. Распространенность САП — 1:10 000 новорожденных, преимущественно поражает женский пол, соотношение женщины/мужчины — 17:1, что значительно превышает таковое соотношение в общей популяции (3:1). Характеризуется множеством полипов, малигнизация которых наступает в 100% случаев, и именно при этом синдроме возможна идентификация пораженных индивидов до появления рака. Выделяют 3 классических фенотипа САП.
1. Тяжелая (классическая) форма САП: более 2000, 5000 полипов (или профузный полипоз). Характеризуется возникновением большого количества неоплазий (более 2000) преимущественно в левой половине толстой кишки, ранней манифестацией (до 10 лет), быстрой малигнизацией (в среднем к 35 годам).
2. Умеренная (классическая) форма: наличие сотен и более аденоматозных полипов, типично локализующихся также в дистальных отделах толстой кишки. Неоплазии появляются в возрасте до 10 лет, к 20 годам развиваются у 95% носителей мутации. Малигнизация происходит в среднем к 35 годам.
3. Слабовыраженная (аттенуированная) форма САП, или синдром ACAП: небольшое число (более 20, но менее 100) аденом в большинстве случаев в правой половине толстой кишки, которые появляются в более позднем возрасте (старше 15 лет) [2–5].
Синдром Гарднера (Gardner syndrome) — фенотипический вариант САП. Характеризуется совместным проявлением десмоидных опухолей с неоплазиями желудочно-кишечного тракта. У данной группы пациентов отмечаются остеомы черепа, костно-хрящевые экзостозы, кортикальное утолщение трубчатых костей, аномальный прикус, а также кожные фибромы. Был описан в 1952 году. Следует отметить, что внекишечные проявления весьма вариабельны и могут развиваться до разрастания аденом в толстой кишке [2, 3, 5, 6, 10].
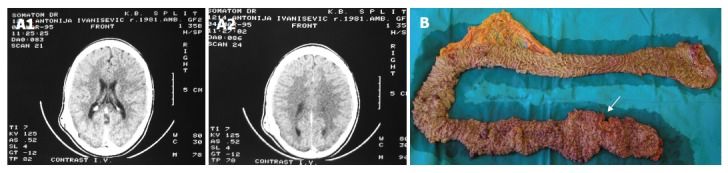
Рис. 1. Синдром Гарднера [10].
А. На компьютерной томограмме с контрастным усилением визуализируется остеома левой височной области.
В. На макропрепарате толстой кишки после колопроктэктомии видны множественные полипы преимущественно в сигмовидной и прямой кишке. Стрелкой указана локализация рака прямой кишки.
Синдром Тюрко (по имени канадского хирурга J. Turcot) также может рассматриваться как один из фенотипических вариантов САП. Впервые описан в 1959 году, характеризуется сочетанием неоплазий толстой кишки с нейроэпителиальными опухолями головного мозга (медуллобластомой (в 80%), пинеобластомой, астроцитомой, пинеаломой или кистами шишковидной железы). Также у пациентов с синдромом Тюрко повышен риск возникновения опухоли печени (гепатобластомы или гепатоцеллюлярного рака), которая развивается наряду с опухолями головного мозга — раньше полипоза толстой кишки (в 2–3 года). Следует отметить, что молекулярный патогенез синдрома Тюрко неоднороден — кроме мутации в гене APC он может быть обусловлен мутациями в генах репарации ДНК (MLH1 или PMS2) и в таком случае относится к синдрому Линча, а члены выявленной семьи должны проходить молекулярный и клинический мониторинг в соответствии с рекомендациями, разработанными именно для синдрома Линча [3, 6, 7].
Молекулярный патогенез САП
Развитие САП связано с мутациями в гене АРС, который идентифицирован на хромосоме 5q21 в 1991 году. Ген АРС относится к генам-супрессорам, состоит из 15 экзонов. Мутации гена АРС в большинстве случаев являются большими делециями, которые трудно выявить. Относятся к герминальным мутациям — подобные мутации присутствуют уже на стадии зиготы и передаются вертикальным путем от родителей. К настоящему времени известно более 900 мутаций. Это дает широкий спектр клинических проявлений заболевания, которые в течение жизни манифестируют в разном возрасте, а тяжесть проявления синдрома зависит от типа мутации в гене АРС. В таблице 1 приведены данные разных авторов по локализациям мутаций в гене АРС и связанные с ними возможные фенотипические проявления заболевания.
Таблица 1. Фенотип-генотип-корреляция при синдроме САП.
|
Мутация в кодонах гена АРС |
Фенотип проявления заболевания |
Источник |
|
Кодон 1250-1464 и 1309 |
Тяжелый (классический) фенотип: более 2000, раннее появление полипов (профузный полипоз – 5000 полипов), быстрая малигнизация |
Friedl W., 2001 [18] Nugent K.P., 1994 [19] Spirio L., 1992 [20] |
|
Кодон 1309 |
Раннее развитие рака |
Nugent K.P., 1994 [19]
|
|
Кодон 157-311 Кодон 412-159 Кодон 1400-1580 |
Умеренно тяжелая (классическая) форма заболевания: 100–2000 полипов (независимый фактор развития КРР) |
Friedl W., 2001 [18]
Soravia C., 1998 [21] |
|
Кодон 1-57, 78-167 Кодон 1581-2843 Кодон 311-412 Кодон 1387 |
Легкая (аттенуированная) форма заболевания со сравнительно небольшим числом полипов и редкими внекишечными проявлениями |
Soravia C., 1998 [21] Nieuwenthus M., 2007 [22] Pang C.P., 2000 [23] |
|
Кодон 1458-1578, 564 |
Полипы фундальных желез |
Bertario L., 2001 [24] |
|
Кодон 1395-1493 и др. регионы |
Аденомы двенадцатиперстной кишки |
– |
|
Кодон 1310 и 2011 Кодон 1444-1578 и в др. регионах |
Риск десмоидных опухолей, остеомы костей (с большой частотой развиваются десмоидные опухоли у детей) |
Caspari R., 1995 [25] |
|
Кодон 216 и 283 Кодон 311-1444 Кодон 413 Кодон 463-1387 |
Врожденная гипертрофия пигментного эпителия сетчатки глаза |
Sieber O.M., 2000 [26] Pang C.P., 2000 [23] Truta B., 2003 [27]
|
|
Кодон 140-1220 (1309) Кодон 457 и 1444 |
Папиллярный рак щитовидной железы |
Cetta F., 2000 [5] Sieber O.M., 2000 [26]
|
|
Кодон 140-1220 Кодон 457 и 1444 |
Опухоли центральной нервной системы |
Cetta F., 2000 [5] Caspari R., 1995 [25] |
|
Кодон 1230 или 1061 Кодон 141, 213, 275, 302 |
Рак печени (гепатобластома) |
Cetta F., 2000 [5]
|
|
Кодон 934, 976 и 1067 |
Риск рака двенадцатиперстной кишки |
Caspari R., 1995 [25] |
Из таблицы 1 видно, что риск развития как фенотипической формы САП, так и внекишечных проявлений возможно предположить по локализации мутаций в гене APC, которые на сегодняшний день изучены достаточно детально [1–7].
В настоящее время отдельно выделяют MUTYH-ассоциированный полипоз, который наследуется аутосомно-рецессивно и обусловлен герминальной мутацией обоих аллелей MUTYH-гена. Толстокишечный фенотип имитирует АСАП, поэтому этот полипозный синдром будет рассмотрен в данном обзоре. Большинство пациентов имеют от 10 до нескольких сотен аденом. Кроме того, биаллельные герминальные MUTYH-мутации были обнаружены у некоторых пациентов с ранним колоректальным раком, не ассоциированным с полипозом. В большинстве случаев у пациентов выявляются аденоматозные полипы, однако у некоторых больных данной группы неоплазии толстой кишки представлены зубчатыми аденомами или сочетанием аденоматозных и зубчатых образований. Колоректальные полипы обычно развиваются в возрасте около 40 лет. Риск КРР составляет 19% в возрасте 50 лет и 43% в возрасте 60 лет. Средний возраст малигнизации составляет 48 лет. Риск возникновения рака у родственников с гетерозиготной MUTYH-мутацией сравним с таковым среди родственников первой степени родства пациентов со спорадическим колоректальным раком.
MUTYH-ген состоит из 16 экзонов и расположен на хромосоме 1p34.3-р32.1. MUTYH кодирует ДНК гликозилаз, участвующих в эксцизионной репарации от 8-oxoG: есть несовпадения, вызванные окислительным повреждением ДНК.
Биаллельные MUTYH-мутации встречаются примерно у 30% пациентов с 10–100 полипами и у 15% пациентов с 100–1000 полипами. У пациентов с >15 синхронными аденомами и КРР в возрасте до 50 есть очень высокий шанс выявления биаллельных MUTYH-мутаций.
Молекулярный и клинический скрининг семей с САП
Клинический диагноз САП подтверждается при колоноскопии выявлением многочисленных полипов у родственников первой линии пораженного пациента. Генетическое тестирование начинают с носителя синдрома. Других родственников тестируют в случае выявления мутации в гене APC у носителя. Риск наследования герминальной мутации составляет 50%, что характерно для любого аутосомно-доминантного заболевания. Герминальная мутация выявляется у 30–80% пациентов с САП, но у 30% она возникает de novo в результате мозаицизма. Если у пораженного полипозом пациента ни APC-, ни MUTYH-мутации не обнаружены или генетическое тестирование не проводилось, родственники первой линии родства обследуются как пациенты с САП. Если же выявлены, то всем родственникам с подозрением на САП проводится прямое тестирование ДНК.
Таблица 2. Клинический мониторинг родственников семей с САП с мутацией в гене APC.
|
Возраст |
Вид исследования |
Интервал |
|
С 10–12 до 35 лет |
Колоноскопия с биопсией |
1–2 года |
|
С 25–30 до 50 лет |
Эзофагогастродуоденоскопия |
1–2 года |
|
С 0 до 10 (15) лет |
УЗИ органов брюшной полости, анализ уровня α-фетопротеина |
6 мес. |
|
2 года |
Исследование головного мозга |
|
|
С 15 лет |
УЗИ щитовидной железы |
1–3 года |
В первую очередь мониторинг САП включает ежегодную колоноскопию с биопсией начиная с 10–12-летнего возраста вплоть до 35 лет. Для родственников колоноскопию нужно начинать с пубертатного возраста или ориентироваться на такие клинические проявления, как диарея, боли в животе, кровь в кале, метаболические расстройства (гипопротеинемия, гипохолестеринемия, гипокалиемия), вторичный иммунодефицит, дисбактериоз. В семьях с аттенуированной формой САП (АСАП) обследование начинают в более позднем подростковом возрасте (с 15 лет). Скрининговые колоноскопии членам семей при САП проводятся до обнаружения первых полипов толстой кишки. Во время выполнения колоноскопии необходимо описать количество полипов, их размер и распределение по отделам толстой кишки, из наиболее крупных полипов берется биопсия. Применение вспомогательных методик визуализации (хромоскопия, узкоспектральный осмотр, осмотр с увеличением) повышает частоту выявления неоплазий толстой кишки у данной группы пациентов (рис. 2).
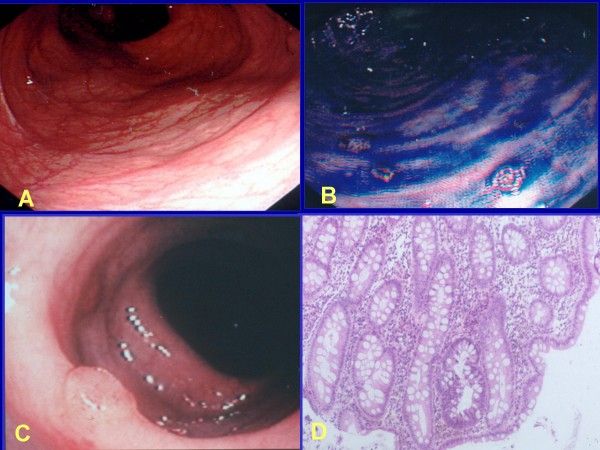
Рис. 2.Эндоскопическая и гистологическая картина ранних проявлений САП [7].
А. Эндоскопическая картина ранних проявлений САП, и трудности в выявлении аденом.
B. После проведения хромоскопии.
С. Аденома, наблюдаемая при аттенуированном САП.
D. Результат неприцельной биопсии при аттенуированном САП (выявлена интраэпителиальная микроаденома).
Следует уделять особое внимание качеству подготовки толстой кишки к эндоскопическому исследованию. В 2014 году был проведен метаанализ, включивший 11 исследований, целью которого было сравнение малообъемного полиэтиленгликоля (ПЭГ) в комбинации с аскорбиновой кислотой (АК) — МОВИПРЕП® — и ПЭГ стандартного объема (4 л) в качестве препаратов для подготовки кишечника к колоноскопии. Метаанализ выявил, что частота нежелательных явлений — рвоты и тошноты — на фоне подготовки малообъемным ПЭГ в комбинации с АК по сравнению с ПЭГ стандартного объема была ниже. Согласно воронкообразному графику, значимых систематических ошибок не выявлено. Таким образом, малообъемный ПЭГ в комбинации с АК не менее эффективен для очистки кишечника в качестве средства подготовки кишечника к колоноскопии, более приемлем для пациентов и характеризуется меньшей частотой нежелательных явлений по сравнению с ПЭГ стандартного объема [12]. В исследовании 2015 года, посвященном сравнению эффективности и безопасности применения комбинированного двухлитрового препарата ПЭГ с раствором электролитов и АК (МОВИПРЕП®, Norgine) и препарата на основе пикосульфата натрия с цитратом магния (ПИКОПРЕП®), показана более высокая эффективность первого для выявления полипов правых отделов толстой кишки и одинаковая эффективность для выявления злокачественных новообразований [11]. Таким образом, для подготовки пациентов к скрининговым колоноскопиям следует рассматривать использование малообъемного препарата полиэтиленгликоля с раствором электролитов и АК (МОВИПРЕП®, Norgine) в сплит-дозе или одноэтапно в день исследования. Схемы подготовки в режиме приема всего объема для очистки кишечника накануне вечером использоваться не должны в связи с неудовлетворительными результатами подготовки правых отделов толстой кишки, что отражено в рекомендациях Европейского общества гастроинтестинальной эндоскопии (European Society of Gastrointestinal Endoscopy) [13].
Для хирургического лечения пациентов с САП, имеющих до 20 полипов, возможно применение эндоскопических методов удаления. В случае невозможности удаления всех полипов или развития КРР больным с САП проводится оперативное лечение в объеме колэктомии или колопроктэктомии с формированием илеоректоанастомоза (илеоанального анастомоза) или постоянной илеостомы. Сроки и объем профилактического хирургического лечения продолжают обсуждаться. Считается возможным сохранение части прямой кишки после выполнения санационной резекции полипов. При этом сохраняется высокая вероятность развития метахронного рака культи прямой кишки: 3,9% через 10 лет и 25,8% через 25 лет [1–6].
Эндоскопическое исследование верхних отделов желудочно-кишечного тракта начинают проводить с 25–30 лет и в зависимости от клинических проявлений повторяют через 2–3 года до 50-летнего возраста. У пациентов после профилактической колэктомии рак двенадцатиперстной кишки — лидирующая причина смертности. Рак двенадцатиперстной кишки в 50% случаев развивается в парафатеральной зоне или ампуле большого дуоденального сосочка, что сопровождается панкреатитом и билиарной гипертензией. Таким образом, пациентам с САП показана дуоденоскопия аппаратом с боковой оптикой. Частота развития полипов двенадцатиперстной кишки составляет 50–90%. Для оценки тяжести полипоза двенадцатиперстной кишки используется классификация Шпигельмана (Spigelman A.D. et al., 1989), согласно которой пациенту начисляются баллы за количество полипов, их размеры и гистологическое строение, потом баллы суммируются и выставляется стадия полипоза (табл. 3).
Таблица 3. Классификация тяжести полипоза двенадцатиперстной кишки по Шпигельману.
|
Признак |
Количество баллов | ||
|
1 |
2 |
3 | |
|
Количество полипов |
1–4 полипа |
5–20 полипов |
Больше 20 полипов |
|
Размеры полипов |
1–4 мм |
5–10 мм |
Больше 10 мм |
|
Гистологический тип |
Тубулярный |
Тубулярно-ворсинчатый |
Ворсинчатый |
|
Степень дисплазии |
Легкая |
|
Тяжелая |
|
Оценка результатов | |||
|
1–4 балла |
1-я стадия | ||
|
5–6 баллов |
2-я стадия | ||
|
7–8 баллов |
3-я стадия | ||
|
9–12 баллов |
4-я стадия | ||
У 80% пациентов, согласно этой классификации, выявлялась 1–3-я стадии поражения, у 20% – 4-я стадия. Риск развития рака двенадцатиперстной кишки наиболее высок у пациентов с 4-й стадией поражения по Шпигельману. Схожие данные были получены в скандинавско-голландских и британских исследованиях. Риск развития рака двенадцатиперстной кишки у всех пациентов с САТК составляет 4,5%. При этом риск малигнизации у больных с 3–4-й стадией по классификации Шпигельмана существенно выше (7–36%) Идентификация такого рода пациентов крайне важна, поскольку позволит выявлять возможное озлокачествление на раннем этапе. При этом случаи развития рака двенадцатиперстной кишки у больных до 30 лет крайне редки. Если у пациента при эзофагогастродуоденоскопии определяется 1-я стадия заболевания по классификации Шпигельмана, ему необходимо выполнение повторного эндоскопического исследования через 2–3 года, при 2-й стадии – через 1–3 года, при 3-й стадии – через 6–12 месяцев, при 4-й стадии необходима оценка возможности хирургического лечения.
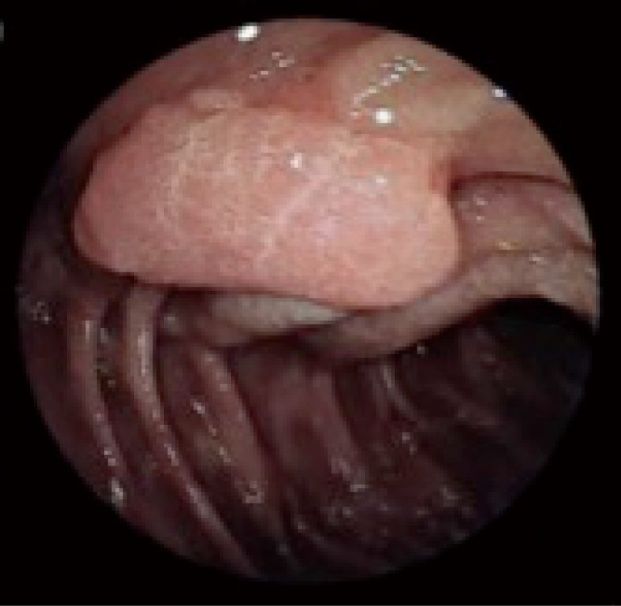
Рис. 3. Аденома двенадцатиперстной кишки 4-й стадии по Шпигельману [6].
Полипы фундальных желез, часто исчисляемые сотнями, наблюдаются у 12,5–84% пациентов с САП. Они могут покрыть всю поверхность кислотопродуцирующего эпителия и даже сливаться, придавая поверхности слизистой матовый вид.
Полипы фундальных желез у пациентов с САП также могут озлокачествляться, но риск их малигнизации не превышает 0,6%. Vice versa: при выявлении полипов фундальных желез у пациентов моложе 40 лет без длительного анамнеза приема ингибиторов протонной помпы им следует назначить колоноскопию для исключения САП. Аденоматозные полипы желудка у пациентов с САП, проживающих в европейских странах, развиваются относительно редко, однако среди жителей Японии и Кореи риск развития рака желудка при САП в 10 раз выше. Чаще всего образование аденоматозных полипов отмечается в антральном отделе желудка. Применение вспомогательных методик визуализации (хромоскопия, узкоспектральный осмотр, осмотр с увеличением) повышает частоту выявления неоплазий желудка у данной группы пациентов [1–8].
Проведение капсульной энтероскопии и двухбалонной энтероскопии для выявления полипов тонкой кишки повышает выявляемость полипов по сравнению с дуодено- и илеоскопией [8].
Частым компонентом САП являются доброкачественные (39–79%) и злокачественные (2–11,8%) новообразования щитовидной железы. Как правило, поражение щитовидной железы — папиллярный рак, при этом часто диагностируется его крибриформная структура, которая почти не встречается в общей популяции. Следует отметить, что рак щитовидной железы манифестирует в возрасте до 28 лет, но при этом отличается более доброкачественным течением, чем спорадические случаи рака той же локализации. Исследование щитовидной железы начинают с 15 лет. Ультразвуковое исследование проводят ежегодно, при необходимости дополняют тонкоигольной биопсией очаговых образований щитовидной железы. Наличие врожденной гипертрофии сетчатки глаза (рис. 4) хотя бы у одного члена семьи или мутация в гене APC с локализацией в кодоне 463-1387 указывает на повышенный риск развития опухоли щитовидной железы.
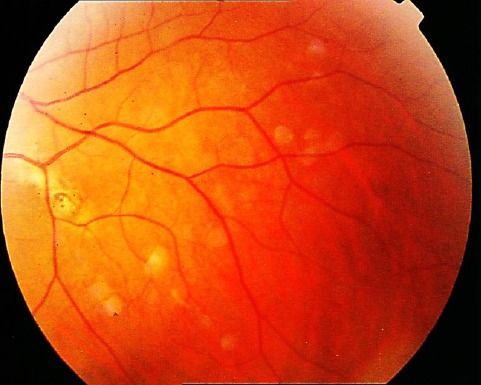
Рис. 4. Врожденная гипертрофия сетчатки глаза [4].
В 1,6% случаев у больных с САП развиваются гепатобластомы. Преимущественно они встречаются у мальчиков, имеющих мутации в 5´-начале гена APC в первые 5 лет жизни.
Для исключения гепатобластомы у детей проводится анализ уровня α-фетопротеина и ультразвуковое исследование органов брюшной полости в возрасте от 2 лет до 10 лет с кратностью 1 раз в 6 месяцев. У некоторых пациентов с САП риск развития гепатобластомы может сохраняться до 15 лет. Указание на гепатобластому у одного из членов семьи служит поводом для обследования пациента с 6-месячного возраста с генетическим тестированием.
Обследование головного мозга следует начинать в возрасте 2 лет. Примерно у 10–15% больных с САП могут развиваться десмоидные опухоли (десмомы). К факторам риска развития этих опухолей относятся абдоминальные хирургические вмешательства, семейный анамнез десмом, локализация мутации в гене APC после 1444 кодона. В отличие от большинства спорадических десмом, опухоли у пациентов с САП чаще всего локализуются в брюшной стенке или внутрибрюшинно. Десмомы могут быть диагностированы с помощью компьютерной томографии или МРТ. Последняя процедура также позволяет выяснить информацию об агрессивности опухоли. Кроме того, десмомы могут обнаруживаться случайно у пациентов, требующих дальнейшего хирургического вмешательства. Лечение десмоидных опухолей комплексное и включает использование нестероидных противовоспалительных препаратов (НПВС) и/или антиэстрогенов, химио- и лучевую терапию, а также их хирургическое удаление. При этом встречаются единичные клинические наблюдения, которые описывают спонтанную регрессию десмоидных опухолей у пациентов с САП при отсутствии какого-либо лечения. Кожные фибромы, эпидермоидные кисты, остеомы черепа, аномалии роста зубов не нуждаются в активном лечении [2, 3].
MUTYH-ассоциированный полипоз наследуется аутосомно-рецессивно. Отличается более доброкачественным течением, развитие КРР отмечается в более позднем возрасте. Полипы желудка и двенадцатиперстной кишки наблюдаются у 11–17% пациентов. Риск развития рака двенадцатиперстной кишки равен 4%, имеется статистически незначимая тенденция к увеличению риска рака желудка. В качестве клинического мониторинга всем носителям мутаций в гене MUTYH показано выполнение эндоскопического обследования начиная с возраста 25 лет каждые 1–2 года, а также проведение эзофагогастродуоденоскопии с 30 лет каждые 1–3 года. При этом выполнение оперативного вмешательства в виде профилактической колэктомии показано тем больным, у которых невозможно эндоскопически удалить все развившиеся аденоматозные полипы [3, 5, 9].
По сравнению с общей популяцией, пациенты с MUTYH-мутациями имеют почти удвоенный риск внекишечных злокачественных новообразований, включая рак яичников, мочевого пузыря, кожи и, возможно, рак молочной железы. Однако исходя из спектра раковых заболеваний и относительно позднего возраста начала, интенсивные меры по эпиднадзору за злокачественными новообразованиями внекишечного типа не рекомендуются [5, 9].
Членам семей с САП, у которых не выявлена мутация в гене APC или MUTYH, проводится скрининг по рекомендациям для общей популяции [1–3, 5, 6].
Выводы
Семейный аденоматозный полипоз толстой кишки — аутосомно-доминантное заболевание, причиной которого является герминальная мутация гена APC, приводящая к развитию множества (>100) тубулярных и тубулярно-ворсинчатых аденом в толстой кишке с микроаденомами между ними и их 100-процентной прогрессии в колоректальный рак в молодом возрасте. КРР, ассоциированный с САП, составляет 1% всех случаев колоректального рака. САП относится к генетически обусловленным мультиопухолевым синдромам, которые представляют собой отдельную группу заболеваний, характеризующихся развитием неоплазий желудочно-кишечного тракта с высоким риском развития онкозаболеваний, в том числе и внекишечной локализации, среди которых встречаются опухоли двенадцатиперстной кишки, щитовидной железы, десмоидные опухоли, гепатобластома и гепатоцеллюлярный рак, опухоли мозга и рак желудка. Диагноз основан на выявлении множественных аденом толстой кишки. Для подготовки к колоноскопии возможно использовать малолитражный ПЭГ с раствором электролитов и АК (МОВИПРЕП®, Norgine). Больные должны быть направлены на медико-генетическое консультирование. Риск развития как фенотипической формы САП, так и внекишечных проявлений возможно предположить по локализации мутации в гене APC. В зависимости от этого членам семей с САП могут быть предложены индивидуальные программы скрининга.
По теме:
Список литературы:
1. Казубская Т.П., Белев Н.Ф., Козлова В.М., Тамразов Р.И., Филиппова М.Г., Ермилова В.Д., Трофимов Е.И., Кондратьева Т.Т. Наследственные синдромы, ассоциированные с полипами и развитием злокачественных опухолей у детей // Онкопедиатрия. — 2015. — №2 (4). — С. 384–395. DOI: 10.15690/onco.v2.i4.1465. «КиберЛенинка»: https://cyberleninka.ru/article/n/nasledstvennye-sindromy-assotsiirovannye-s-polipami-i-razvitiem-zlokachestvennyh-opuholey-u-detey.
2. Казубская Т. П., Козлова В.М, Филиппова М.Г., Трофимов Е.И., Белев Н.Ф., Соколова И.Н., Тамразов Р.И., Павловская А.И., Кондратьева Т.Т., Русинова Г.Г., Вязовская Н.С., Азизова Т.В., Ревина В.С., Глазкова И.В., Генерозов Э.В., Захаржевская Н.Б., Гурьянов М.Ю., Белосохов М.В., Осовец С.В. Редкие наследственные синдромы, ассоциированные с полипозом и развитием злокачественных опухолей // Архив патологии. — 2016. — №78 (2). — С. 10–18. DOI: 10.17116/patol201678210-18:
3. Цуканов С.А. Стратегия комплексного молекулярно-генетического изучения наследственных форм колоректального рака у российских пациентов : автореф. дисс. на соискание степени д. м. н. — М., 2017.
4. Aihara H., Kumar N., Thompson C.C. Diagnosis, surveillance, and treatment strategies for familial adenomatous polyposis: rationale and update. Eur J Gastroenterol Hepatol. 2014. Mar; 26 (3) : 255–262. DOI: 10.1097/MEG.0000000000000010.
5. Brosens L.A., Offerhaus G.J., Giardiello F.M. Hereditary Colorectal Cancer: Genetics and Screening. Surg Clin North Am. 2015. Oct; 95 (5): 1067–1080. Epub 2015 Jun 16. DOI: 10.1016/j.suc.2015.05.004.
6. Campos F.G., Martinez C.A.R., Bustamante Lopez L.A., Kanno D.T., Nahas S.C., Cecconello I. Advanced duodenal neoplasia and carcinoma in familial adenomatous polyposis: outcomes of surgical management. J Gastrointest Oncol. 2017 Oct; 8 (5): 877–884. DOI: 10.21037/jgo.2017.09.03.
7. Half E., Bercovich D., Rozen P. Familial adenomatous polyposis. Orphanet J Rare Dis. 2009. Oct 12; 4: 22. DOI: 10.1186/1750-1172-4-22.
8. Mirinezhad S.K., Mousavi F., Baghri M., Sepehri B., Ghavidel A., Ghojazadeh M., Somi M.H. Congenital Hypertrophy of Retinal Pigment Epithelium for Diagnosis of Familial Adenomatous Polyposis — the First FAP registry in Iran. Asian Pac J Cancer Prev. 2018. Jan 27; 19 (1): 167–169.
9. Nielsen M., Lynch H., Infante E., Brand R. MUTYH-Associated Polyposis. In: Adam M.P., Ardinger H.H., Pagon R.A., Wallace S.E., Bean L.J.H., Stephens K., Amemiya A., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993–2018. 2012 Oct 4 [updated 2015 Sep 24].
10. Smud D., Augustin G., Kekez T., Kinda E., Majerovic M., Jelincic Z. Gardner's syndrome: genetic testing and colonoscopy are indicated in adolescents and young adults with cranial osteomas: a case report. World J Gastroenterol. 2007. Jul 28; 13 (28): 3900–3903. DOI: 10.3748/wjg.v13.i28.3900.
11. Pohl J., Halphen M., Kloess H.R., FischbachW. Impact of the Quality of Bowel Cleansing on the Efficacy of Colonic Cancer Screening: A Prospective, Randomized, Blinded Study. PLoS One. 2015. May 7; 10 (5): e0126067. DOI: 10.1371/journal.pone.0126067.
12. Xie Q., Chen L., Zhao F., Zhou X., Huang P., et al. (2014) A Meta-Analysis of Randomized Controlled Trials of Low-Volume Polyethylene Glycol plus Ascorbic Acid versus Standard-Volume Polyethylene Glycol Solution as Bowel Preparations for Colonoscopy. PLoS One.9 (6): e99092. DOI: 10.1371/journal.pone.0099092.
13. Hassan C., Bretthauer V., Kaminski M.F.,Polkowski M., Rembacken B., Saunders B., Benamouzig R., Holme O.,Green G., Kuiper T., Marmo R., Omar M., Petruzziello L., Spada C., Zullo A., Dumonceau J.M. Bowel preparation for colonoscopy: European Societyof Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2013; 45: 142–150. DOI: 10.1055/s-0032-1326186.
Рекомендуемые статьи
Синдром Бейфорда
сдавление пищевода аномальной подключичной артерией сопровождающееся дисфагией.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.















.jpg)





.png)
















Комментарии