- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Перевод статьи. Эндоскопическая диагностика раннего рака желудка Kenshi Yao 2013
| Авторы: | Kenshi Yao 1 перевод от Серикбай Майканович Тергеусизов 2 2013г. |
| Об авторах: |
1. Fukuoka University Chikushi Hospital, Japan 2. Врач хирург-эндоскопист РГП на ПХВ «НИИ травматологии и ортопедии». г.Нур-Султан |

















Полный текст статьи:
Оригинал статьи:
Эндоскопическая диагностика раннего рака желудка
Кенши Яо
(перевод Тергеусизов С.М.)
За пределами Японии эндоскопическая диагностика рака желудка на ранних стадиях действительно сложна, потому что при эндоскопическом обследовании часто выявляются лишь незначительные изменения, а у эндоскопистов мало возможностей ознакомиться с систематическими методами и современными знаниями. Эндоскопическая диагностика рака желудка на ранних стадиях делится на два этапа: обнаружение и определение характеристик. В этой статье я объясню, во-первых, как обнаруживать подозрительные поражения, а во-вторых, как охарактеризовать обнаруженные поражения, чтобы поставить точный диагноз. Основные принципы выявления рака желудка на ранней стадии с помощью традиционной эндоскопии.
Чтобы обнаружить поражения, подозрительные на ранний рак желудка, мы должны ознакомиться с основными принципами 1) техники и 2) знаний.
Техника
Идеальная подготовка
Правильная подготовка к эндоскопическому исследованию является обязательной для минимизации времени и усилий при удалении слизи и пены с поверхности слизистой оболочки во время процедуры.
За 30 минут до процедуры пациента просят выпить смесь воды с муколитиком и пеногасителями.
Формула в Японии:
1. 100 мл воды с 20000 ед. Проназы (Kaken Pharmaceutical, Токио, Япония),
2. 1г бикарбоната натрия и 10 мл диметилполисилоксана (20 мг/мл, Horii Pharmaceutical Ind., Осака, Япония).
3. Однако Pronase доступен не во всех странах.
4. Альтернативная смесь 100 мл воды, смешанные с 2 мл ацетилцистеина (200 мг/мл Parvolex, Celltech, Великобритания; или Mucomyst, Bristol-Myers Squibb, США), и 0,5 мл (40 мг/мл) активированного диметикона (Infacol, Forest Laboratories, Великобритания).
Использование антиперистальтического средства
В физиологическом состоянии стенка желудка всегда движется за счет перистальтики.
Чтобы обнаружить незначительные изменения слизистой оболочки, необходимо тщательно сканировать всю поверхность слизистой оболочки. В связи с этим перистальтика затрудняет для эндоскописта получение статических наблюдений. Соответственно, мы обычно вводим антихолинергический агент, такой как 10-20 мг бутилбромида скополамина (Бускопан), внутримышечно или внутривенно непосредственно перед введением эндоскопа, даже для скрининговых эндоскопий верхних отделов желудочно-кишечного тракта (ЖКТ). Если есть противопоказания к применению холинолитиков (например, сердечно-сосудистые заболевания), можно ввести 1 мг глюкагона для подавления перистальтики.
Как избежать слепых пятен: протокол систематического скрининга желудка (SSS)
Во время эндоскопии, чтобы избежать слепых пятен, мы должны использовать стандартизированную процедуру для картирования всего желудка.
Основной метод предотвращения слепых пятен включает следующие процедуры:
1) расширение стенки желудка путем вдувания воздуха,
2) смывание слизи и пены со слизистой оболочки желудка с помощью орошения водой и пеногасителем
3) картирование всего желудка.
Разберемся, зачем нужны такие шаги
1) Если мы не расширяем стенку желудка, мы можем не обнаружить рак на большей кривизне, даже если рак на довольно поздней стадии, как показано на фото 1. 2) Если мы не смываем слизь и пену, мы вполне можем пропустить малозаметные изменения, позволяющие обнаружить ранний рак желудка[1].
3) Не существует общепринятого во всем мире стандартизированного метода картирования всего желудка. В Японии мы разработали протокол систематического обследования верхних отделов ЖКТ.
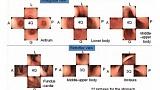
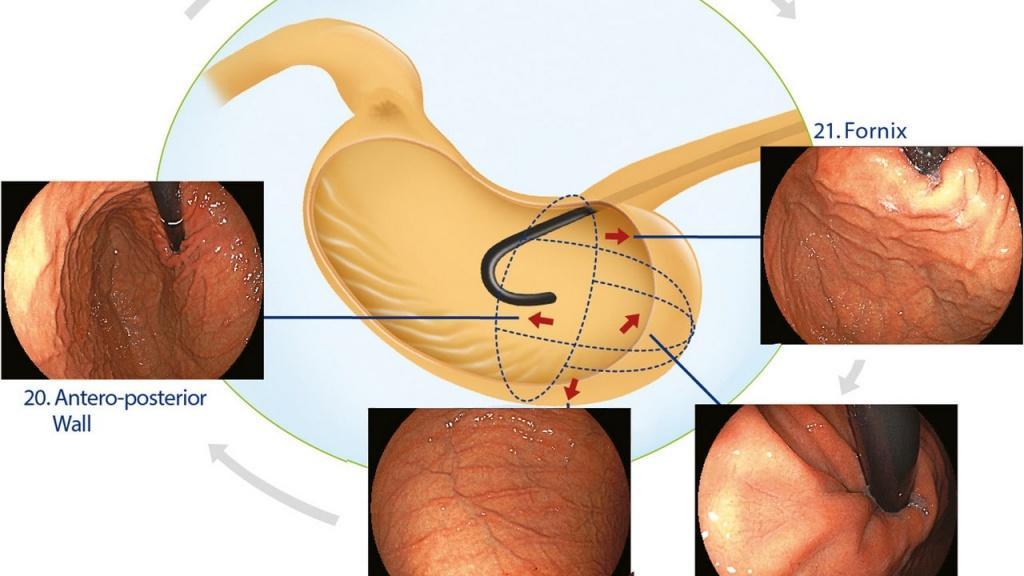
Однако хорошо спланированных исследований не было. Другая проблема заключается в том, что количество изображений кажется слишком большим для зарубежных эндоскопистов, чтобы запомнить все участки, а протокол слишком сложен для использования в клинической практике. Недавно Японское общество гастроэнтерологического скрининга рака (JSGCS) опубликовало упрощенный протокол [2], тем не менее, это все еще трудно запомнить. С другой стороны, протокол, предложенный Европейским обществом эндоскопии желудочно-кишечного тракта (ESGE) [3], включает только 4 изображения желудка. Эндоскописты с более длительным временем процедуры, которые делают более 4 снимков, обнаруживают больше патологий, чем эндоскописты с более коротким временем процедуры и меньшим количеством снимков [4]. Это говорит о том, что более длительное обследование и увеличение количества снимков могут повысить скорость обнаружения поражения [4]. С этой точки зрения мы хотели бы предложить минимально необходимый стандарт, «протокол систематического скрининга желудка (SSS)», как показано на рисунке 2.
В SSS изображения располагаются в соответствии с порядком выполнения процедуры, и мы можем делать снимки 4- или 3-квадрантных видов по часовой стрелке или против часовой стрелки.
SSS - это базовая концепция, показывающая минимально необходимый стандарт.
Если вы обнаружите поражения, можно сделать дополнительные снимки.
Если ваша эндоскопическая система не подключается к системе хранения изображений, SSS следует использовать в качестве контрольных точек.
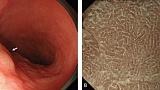
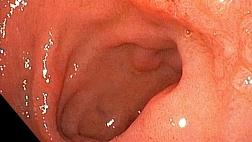
Эндоскопическая картина распространенного рака желудка по большей кривизне н/3 трети тела желудка.

фото1
(A) При вдувании небольшого количества воздуха внешний вид нормальный.
(B) Однако, когда мы инсуфлируем больше воздуха и расширяем просвет желудка по большей кривизне становится очевидным отчетливое поражение, указывающее на запущенный рак желудка. Гистопатологический диагноз биопсии - инвазивная карцинома из перстневидныхых клеток.
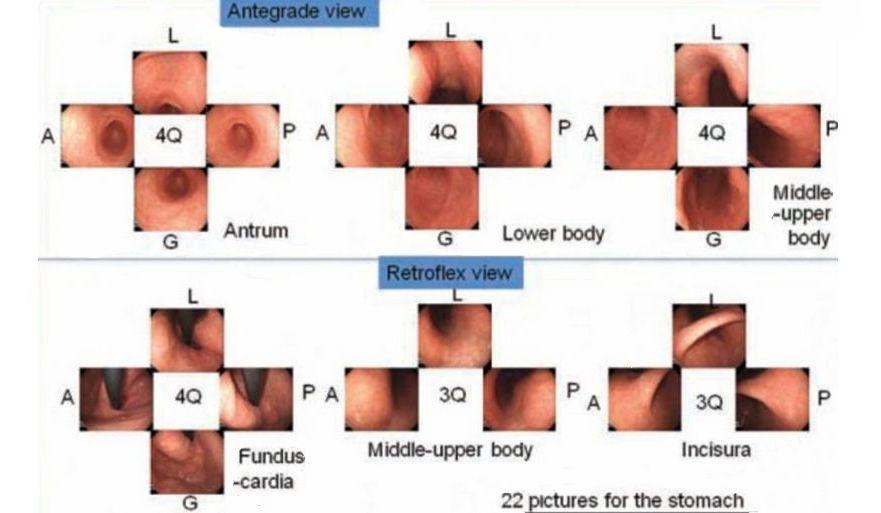
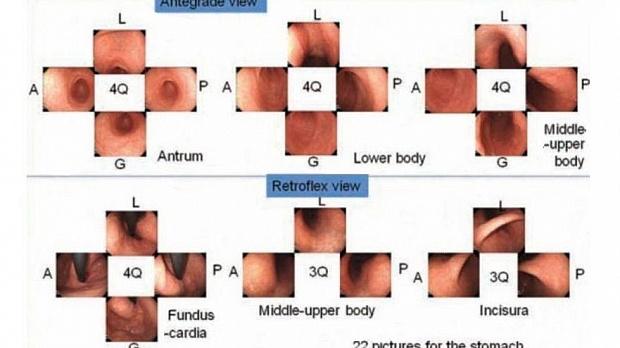
рисунок 2 SSS, протокол систематического скрининга
Q - квадрант; L - малая кривизна; А - передняя стенка; G - большая кривизна; P- задняя стенка;
SSS следует начинать, как только мы вводим зонд в антральный отдел желудка.
В целом серия SSS включает 22 эндоскопических фото.
При антеградном обзоре мы должны сделать эндоскопические фотографии 4 квадрантов:
a. антрального отдела желудка
b. нижняя часть тела желудка
c. средней и верхней части тела желудка
При ретрофлексии мы делаем эндоскопические фото
d. 4-х квадрантов дна и кардии желудка
e. 3-х квадрантов средней и верхней части тела желудка
f. 3-х квадрантов угла желудка
От редактора:
SSS (systematic screening protocol for the stomach) - это система\протокол для стандартизации осмотра и фотодокументирования врачом эндоскопистом, при осмотре\скрининге желудка. В целом серия SSS включает 22 эндоскопические фотографии. Kenshi Yao. The endoscopic diagnosis of early gastric cancer. Ann Gastroenterol. 2013; 26(1): 11-22.
Ниже по ссылке современная система "SACE" разработанная WEO OMED 2019г.
Систематическое буквенно-цифровое кодирование эндоскопии (systematic alphanumeric-coded endoscopy-SACE) - это система или алгоритм для врача эндоскописта для стандартизации фотодокументирования верхних отделов ЖКТ. Разработчики: Fabian Emura, Prateek Sharma, Vitor Arantes, et al. подробнее в публикации по ссылке:
Определение риска развития рака желудка на ранних стадиях по данным эндоскопии фоновой слизистой оболочки желудка
Как только мы вводим эндоскоп в желудок, мы должны определить , используя эндоскопический осмотр, присутствуют ли в фоновом режиме слизистой оболочке факторы риски развития рака желудка, такие как Helicobacter Pylori -associated гастрит, атрофия желудка или кишечная метаплазия [5 -10].
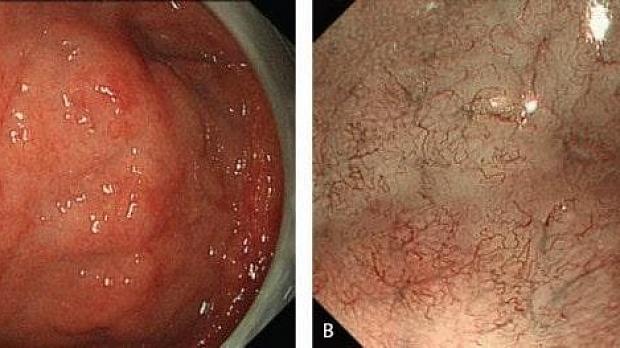
Если слизистая оболочка желудка имеет нормальный вид и не имеет ни одного из вышеперечисленных факторов риска, вероятность возникновения поражений, подозрительных на рак желудка, снижается. Увеличительная эндоскопия, если таковое имеется, полезна для определения того, сопровождается ли слизистая оболочка желудка такими факторами риска (Рис. 3,4)[ 6 , 7 ].

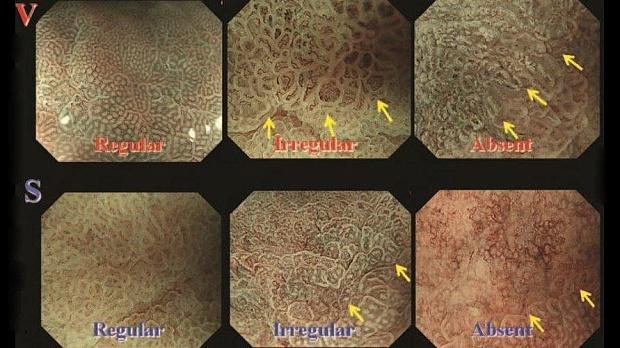
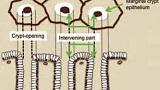
Рисунок 3
SECN - субэпителиальная капиллярная сеть; RAC - регулярное расположение собирающих венул;
СО - ямки эпителия; MCE - эпителий краевой крипты; CV - сливающиеся коллекторные венулы
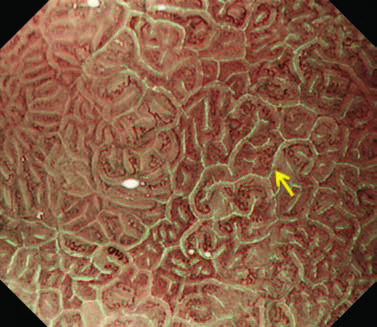
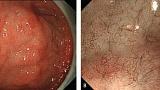
Увеличительная эндоскопия слизистой оболочки фундальных желез желудка. Наблюдение с помощью эндоскопии под увеличением слизистой оболочки фундальных желез желудка (дна и тела) для оценки риска рака желудка.
(A, B) Нормальная слизистая оболочка тела желудка.
На микроповерхности видны:
· регулярный сотовый рисунок (ямок эпителия)
· СО - правильный овал крипты эпителия (коричневатый цвет)
· SECN - субэпителиальная капиллярная сеть (коричневатый цвет)
· RAC - регулярно расположенные собирательные (коллекторные) венулы (голубой цвет)
· CV – объемные (сливающиеся) коллекторные венулы
· MCE - овальная краевая крипта (беловатая полупрозрачная часть)
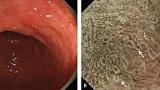
(C) Гастрит, ассоциированный с Helicobacter pylori . Когда слизистая желудка сопровождается Helicobacter pylori-ассоциированный гастрит, микрососудистые и микроповерхностные структуры демонстрируют заметные диффузные изменения по сравнению с нормальной слизистой оболочкой.
А именно, паттерн SECN расширен, и CV не визуализируется в воспаленной слизистой оболочке, в то время как MCE имеет изогнутую / овальную форму, которая отличается от нормальной морфологии, а CO не визуализируется как коричневатая ямка.
(D) Атрофический гастрит.
При выраженной атрофии слизистой оболочки тела желудка. CV можно снова визуализировать, однако нельзя идентифицировать сотовый паттерн SECN, и ни MCE, ни CO не могут быть идентифицированы в сильно атрофированной слизистой оболочке. Подобные изменения также выявляется при аутоиммунном гастрите, а также при распространенном атрофическом гастрите, связанном с инфекцией Helicobacter pylori.
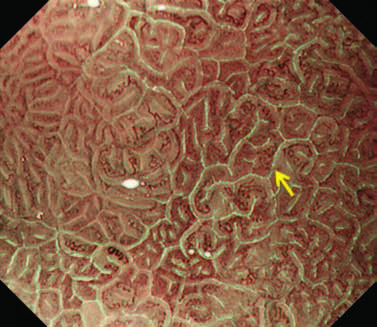
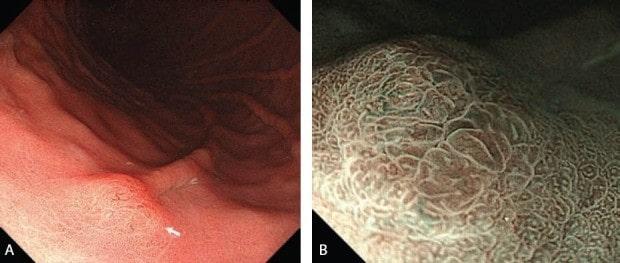
NBI кишечной метаплазии.
Рисунок 4 LBC - голубой гребень
Мы иногда сталкиваемся с уникальным явлением, называемым LBC, на границе MCE, когда наблюдаем хронический гастрит, ассоциированный с Helicobacter pylori [7].
LBC изначально определяется как тонкая сине-белая линия на гребне эпителиальной поверхности. Наличие LBC подтверждает гистологически кишечную метаплазию.
Осведомленность о признаках подозрительных поражений
Ранние неоплазии желудка как полиповидного, так и язвенного типа легко обнаруживаются,
если мы будем следовать SSS с оптимальной подготовкой. Тем не менее, поверхностные поражения слизистой оболочки, имитирующие гастрит (поражения, подобные гастриту), очень трудно обнаружить даже при оптимальной подготовке и хорошем оснащении [ 11 ]. Соответственно, мы должны знать ключевые признаки выявления поверхностных новообразований слизистой оболочки.
Два разных маркера для обнаружения - это поверхность (Рис. 5) и изменение цвета Рис. 6) Другими маркерами являются изменения отражения света (Рис. 5) и спонтанное кровотечение (Рис. 6).

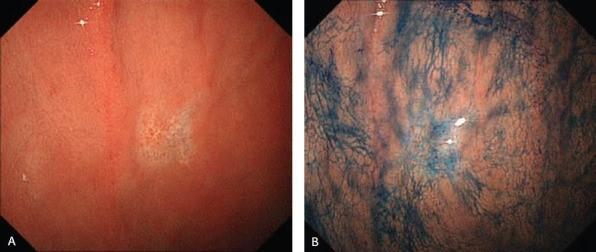
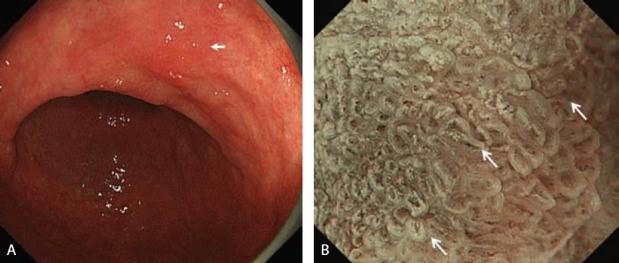
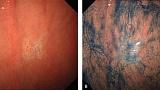
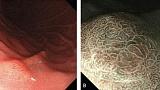
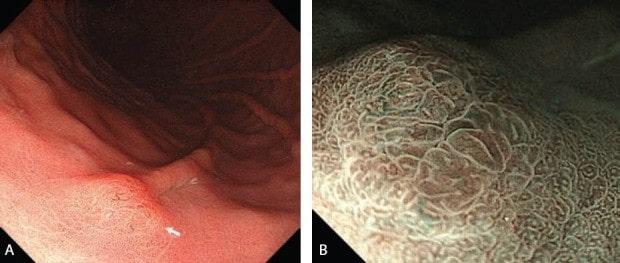
Эндоскопические данные раннего рака желудка плоско-возвышающегося (0 IIa) типа
в антральном отделе желудка. Гистологический тип: дифференцированный (кишечный) тип.
Рисунок 5
(A) Обычная визуализация в белом свете показывает слегка приподнятое поражение. Отражение света предполагает нечто иное в морфологии поверхности.
(B) Хромоэндоскопия индигокармином демонстрирует хорошо разграниченное поверхностное приподнятое поражение с неровным рисунком поверхности.

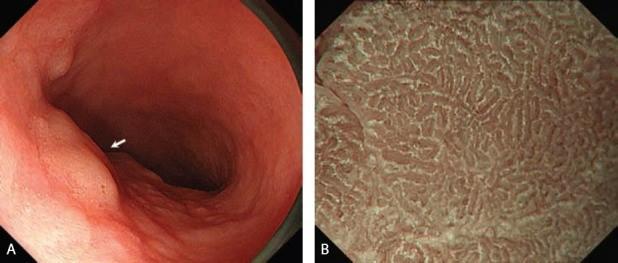
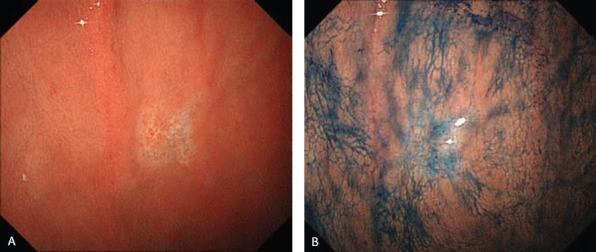
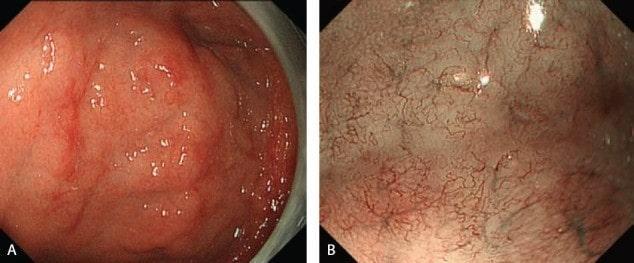
Эндоскопические данные раннего рака желудка поверхностного депрессивного (0 IIc) типа
в кардии желудка. Гистологический тип: дифференцированный (кишечный) тип.
Рисунок 6
(A) Обычная визуализация в белом свете показывает покрасневшее депрессивное поражение со спонтанным кровотечением.
(B) Хромоэндоскопия индигокармином демонстрирует хорошо разграниченное поражение с нерегулярным краем.
Эндоскопические данные раннего рака желудка поверхностного депрессивного (0 IIc) типа
в теле желудка. Гистологический тип: недифференцированный (диффузный) тип.
Рисунок 7
(A) Обычная визуализация в белом свете демонстрирует бледное вдавленное поражение.
(B) Хромоэндоскопия индигокармином очерчивает границы образования.
Основные принципы характеристики обнаруженных поражений
Характеристика с использованием обычного белого света (C-WLI) или хромоэндоскопии (CE)
После обнаружения подозрительного поражения с помощью тщательного SSS с использованием обычной эндоскопии, нам необходимо различать раковые и незлокачественные поражения (характеристики). Для характеристики необходимо использовать два разных маркера, а именно цвет и морфологию поверхности, для интерпретации результатов эндоскопии C-WLI.
CE с использованием индигокармина полезен для улучшения рисунка поверхности (Рис. 5B)
Дифференциальный диагноз мы ставим по следующим критериям:
1) Граница четко обозначенная.
2) Неравномерность цвета / рисунка поверхности.
Если результаты C-WLI или CE соответствуют обоим критериям, мы ставим эндоскопический диагноз раннего рака желудка. Однако трудно правильно диагностировать мелкий рак желудка (≤5 мм) или поверхностный плоский (0 IIb) рак желудка с помощью C-WLI или CE, потому что эти типы поражений дают только неспецифические результаты с использованием только обычной эндоскопии. В таких случаях следующая расширенная визуализация полезна для дифференциации малого / плоского рака и очагового гастрита. Характеристика с помощью увеличительной эндоскопии с узкополосной визуализацией (M-NBI). Поскольку с помощью M-NBI мы можем четко визуализировать как микрососудистый рисунок, так и рисунок микроповерхности [ 13 ], M-NBI является многообещающим методом для характеристики малых или плоских ранних форм рака желудка. Мы разработали методику M-NBI и предложили комплексную диагностическую систему, «систему классификации VS (сосуд плюс поверхность)» [ 14 ]. Мы продемонстрировали клиническое применение техники M-NBI и системы классификации VS [ 15 - 21 ].
Техника M-NBI с использованием насадки (дистальный колпачок)
Мягкий черный колпачок (MAJ-1988 для GIF-Q240Z, MAJ-1989 для GIF-H260Z и GIF-Q160Z; Olympus, Tokyo) необходим для оптимальной эндоскопии с увеличением. Перед обследованием на кончик эндоскопа устанавливается колпачок, чтобы врач-эндоскопист мог последовательно зафиксировать слизистую оболочку на расстоянии примерно 2 мм, при котором может быть получено максимальное увеличение эндоскопического изображения (Рис. 8). Поскольку глубина колпачка очень мала, она не нарушает поле зрения во время наблюдения без увеличения. К тому же, поскольку колпачок мягкий, он не травмирует слизистую. Фактически, когда эндоскопия с увеличением верхнего отдела желудочно-кишечного тракта проводилась в более чем 600 случаях скрининговой эндоскопии с использованием такого мягкого дистального колпачка, не было никаких осложнений, таких как контактное кровотечение, или каких-либо нежелательных инцидентов, таких как потеря колпачка. [ 16 ].

На кончик увеличительного эндоскопа крепится мягкий черный дистальный колпачок.
Рисунок 8
Система классификации VS для дифференциальной диагностики раковых и доброкачественных поражений
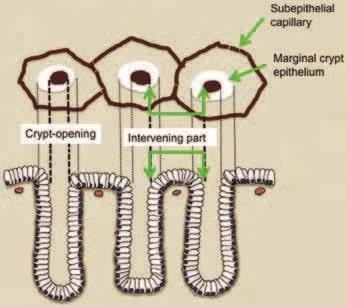
Визуализация микроанатомии желудка с помощью M-NBI [ 22 ]
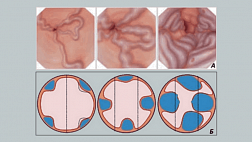
Поскольку слизистая оболочка желудка состоит из железистого эпителия, мы должны уточнить корреляцию между микроанатомией и реальными изображениями, визуализированными с помощью M-NBI (Рис.9). Основные микроанатомические данные, визуализированные с помощью M-NBI, подразделяются на микрососудистые и микроповерхностные модели.
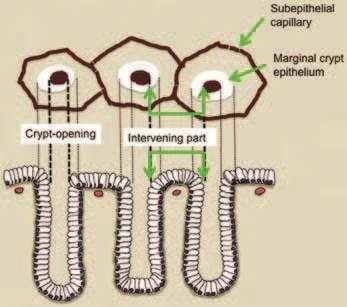
Рисунок 9
Корреляция между микроанатомией (нижний столбец)
и эндоскопическими изображениями (верхний столбец)
V: микрососудистый рисунок
- Субэпителиальный капилляр (SEC)
- Собирательные венулы (CV)
- Патологические микрососуды (МВ)
S: микроповерхность
- Маргинальный эпителий крипт (MCE)
- Открытые ямки крипт эпителия (CO)
- Промежуточная часть (IP) между ямками эпителия
Классификация VS использует вышеуказанные анатомические термины при интерпретации эндоскопических данных (микрососудистые и микроповерхностные структуры), полученных с помощью M-NBI. На практике микроваскулярный и микроповерхностный рисунок следует анализировать независимо.
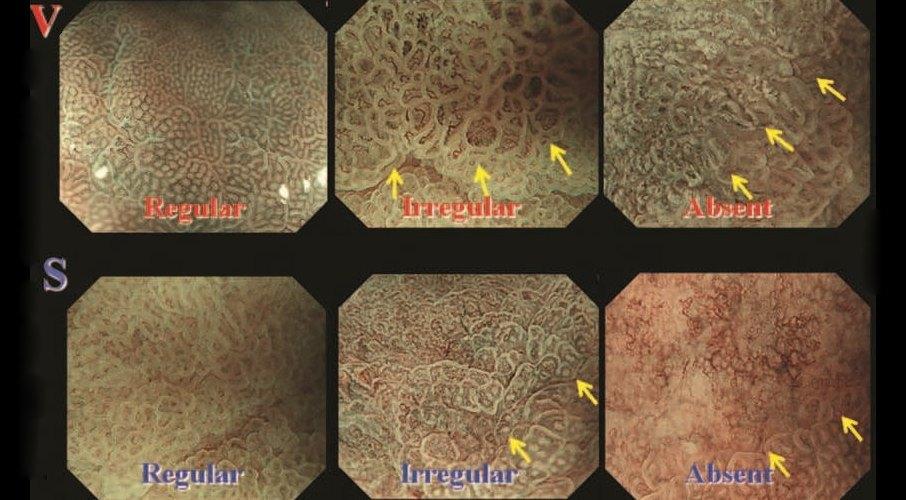
Рисунок 10 Стрелки показывают демаркационные линии
Микрососудистый рисунок (V)
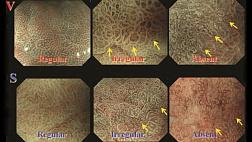
Различают три категории микрососудистого паттерна:
1. «Регулярный микроваскулярный узор» : капилляры слизистой оболочки имеют однородную форму, которая может быть замкнутой (многоугольной) или открытой. Они имеют однородную морфологию, симметричное распределение и правильное расположение.
2. «Неправильный микроваскулярный узор» : сосуды различаются по форме: они имеют замкнутую (многоугольную), разомкнутую, извилистую, разветвленную или причудливую форму, с сеткой или без нее. У них неоднородная морфология, асимметричное распределение и неправильное расположение.
3. «Отсутствие микрососудистого паттерна» : субэпителиальный микроваскулярный паттерн не виден из-за наличия белого непрозрачного вещества (WOS) в поверхностной части слизистой оболочки [ 17 ].
Рисунок микроповерхности (S)
Различают три категории рисунка микроповерхности:
1. «Регулярный узор микроповерхности» : морфология эпителия маргинальной крипты показывает однородную линейную / изогнутую / овальную / круговую структуру. Он показывает однородную морфологию, симметричное распределение и правильное расположение. WOS может быть дополнительным маркером регулярного рисунка микроповерхности, определяемого как хорошо организованное и симметричное распределение WOS в регулярном сетчатом / лабиринтном / пятнистом образце.
2. «Нерегулярный рисунок микроповерхности» : морфология эпителия маргинальной крипты показывает неправильную линейную / изогнутую / овальную / круглую / ворсинчатую структуру. Он показывает неоднородную морфологию, асимметричное распределение и неправильное расположение. Когда присутствует WOS, нерегулярный WOS может быть дополнительным маркером нерегулярного рисунка микроповерхности, определяемого как неорганизованное и асимметричное распределение WOS в нерегулярном сетчатом / пятнистом рисунке.
3. «Отсутствие микроповерхностного рисунка» : ни эпителиальная структура краевого крипт, ни WOS не видны при использовании M-NBI.
В соответствии с системой классификации VS характерные результаты M-NBI для раннего рака желудка представляют собой четкую демаркационную линию между фоновой доброкачественной слизистой оболочкой и злокачественной слизистой оболочкой, а также нерегулярный микроваскулярный рисунок и / или неправильный рисунок микроповерхности в пределах демаркационной линии. Соответственно, мы устанавливаем следующие критерии для постановки диагноза рака желудка:
1)Неровный узор микрососудов с разграничительной линией.
2)Неправильный рисунок микроповерхности с разграничительной линией.
Если результаты эндоскопии соответствуют одному или обоим, мы ставим диагноз рака, и мы ставим диагноз «не рак», если ни один из них не подтвердился. Согласно нашим исследованиям, 97% ранних стадий рака желудка соответствуют указанным критериям [ 14 ].
Клиническое применение M-NBI
Используя технику M-NBI и систему классификации VS, мы разработали 3 основных клинических применения M-NBI следующим образом [ 18 - 21 ]:
1. Обычная скрининговая эндоскопия: дифференциация раннего рака желудка и очагового гастрита. Очень сложно точно диагностировать небольшой ранний рак желудка, используя только C-WLI.
2. Мы исследовали диагностическую производительность C-WLI в реальном времени по сравнению с M-NBI в многоцентровом проспективном рандомизированном контролируемом исследовании пациентов с недиагностированными небольшими депрессивными образованиями, выявленными при эзофагогастродуоденоскопии.
3. Мы сравнили диагностическую точность, чувствительность и специфичность C-WLI и M-NBI, а также оценили диагностическую ценность M-NBI, выполненного в сочетании с C-WLI.
Всего было выявлено 40 случаев рака желудка (по 20 в каждой группе). Средние диагностические значения для M-NBI и C-WLI были следующими: точность 90,4% и 64,8%, чувствительность 60,0% и 40,0% и специфичность 94,3% и 67,9% соответственно. Точность и специфичность для M-NBI были выше, чем для C-WLI (P <0,001). Комбинация M-NBI и C-WLI значительно повысила производительность по сравнению с одним C-WLI. Фактически, точность увеличилась с (медиана) 64,8% до 96,6% (P = 0,001), чувствительность - с 40,0% до 95,0% (P = 0,001), и специфичность от 67,9% до 96,8% (P = 0,001). M-NBI в сочетании с C-WLI выявляет небольшие депрессивные злокачественные опухоли слизистой оболочки желудка с точностью 96,6%, чувствительностью 95,0% и специфичностью 96,8%. Эти значения лучше, чем для C-WLI или M-NBI. Это исследование продемонстрировало, что M-NBI чрезвычайно полезен для постановки точного диагноза только на основании эндоскопических данных, даже при небольших депрессивных поражениях, ранее ограниченных C-WLI (Рис. 11) [ 18 ].
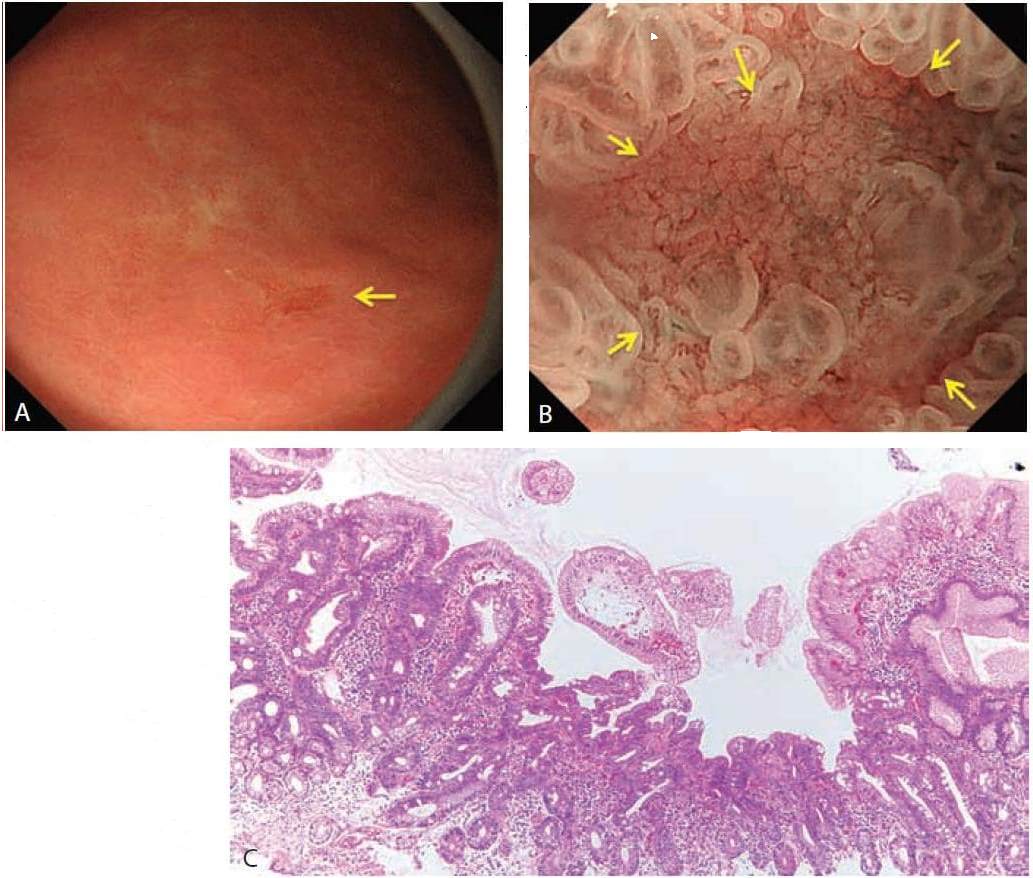
Слегка вдавленное поражение антрального отдела желудка (не злокачественное, 5 мм).
C-WLI-обычное изображение в белом свете;
M-NBI-увеличительная эндоскопия с узкополосной визуализацией
Рисунок 11
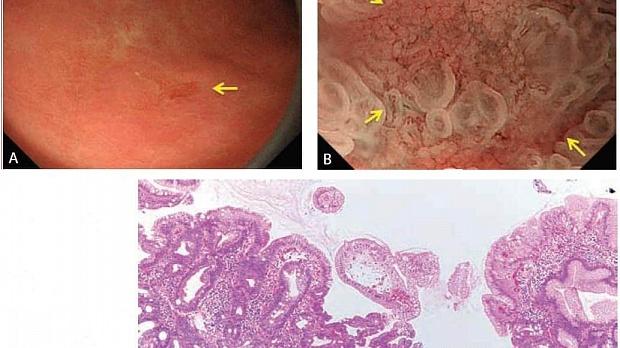
(A) C-WLI демонстрирует слегка вдавленное очаговое поражение с неровными краями (стрелка). Это поражение подозрительно на рак только с помощью C-WLI.
(B) M-NBI (классификация VS) демонстрирует регулярный рисунок микрососудов и регулярный рисунок микроповерхности с демаркационной линией (стрелки). Результаты M-NBI позволяют нам точно диагностировать это как доброкачественное поражение.
(C) Гистопатологические результаты биопсии представляют хронический гастрит с кишечной метаплазией.

Слегка вдавленное поражение антрального отдела желудка (не злокачественное, 3 мм).
C-WLI -обычное изображение в белом свете; M-NBI-увеличивающая эндоскопия с узкополосной визуализацией; VS-сосуды плюс поверхность
Рисунок 12
(A) C-WLI демонстрирует слегка вдавленное, плохо разграниченное поражение с правильным краем (стрелка). Это поражение не вызывает подозрений на рак только с помощью C-WLI.
(B) Однако исследование с использованием M-NBI демонстрирует нерегулярный рисунок микрососудов и отсутствие рисунка микроповерхности с четкой демаркационной линией. Согласно системе классификации VS, эти результаты соответствуют критериям злокачественного поражения.
(C) Гистопатологические данные резецированного образца методом эндоскопической диссекции представляют собой хорошо дифференцированную аденокарциному, ограниченную слизистой оболочкой.
Предоперационная оценка латеральной степени раннего рака желудка
для радикальной эндоскопической резекции
Эндоскопия с увеличением позволяет точно определить горизонтальную протяженность ранних стадий рака желудка до эндоскопической диссекции подслизистой оболочки (ESD) [ 15 ]. Недавно мы сообщили о преимуществах M-NBI перед C-WLI с распылением красителя (CE) [ 19 ]. Мы исследовали полезность и ограничения ME с NBI, когда с CE мы не можем определить горизонтальную степень раннего рака желудка. В исследование была включена серия из 350 последовательных ранних случаев рака желудка, удаленных единым блоком с использованием ESD. Доля раковых заболеваний с нечеткими границами при использовании CE составила 18,9% (66/350). Из них 62 из 66 видов рака были исследованы с использованием ME с NBI, при этом все края успешно очерчены в 72,6% (45/62) поражений с нечеткими краями с помощью CE (Рис 13) [ 19 ]. Однако показатель успеха диагностики недифференцированного рака составил 0%, что значительно ниже, чем для дифференцированных поражений (P <0,001). Соответственно, M-NBI с использованием системы классификации VS является отличным методом для определения всей границы раннего рака желудка, когда границы неясны с помощью CE. По-прежнему трудно оценить латеральную распространенность раннего недифференцированного рака желудка только с помощью эндоскопических данных, поэтому стратегия эндоскопической диагностики различается в зависимости от гистологического типа, как показано наРисунок 14. В сложных случаях мы рекомендуем, чтобы клиническая стратегия в этих случаях заключалась в взятии образцов биопсии из явно доброкачественной ткани вокруг поражения, а затем определении границ резекции после гистологического подтверждения отсутствия раковой инвазии в образцах биопсии.

Ранний рак желудка поверхностного плоского типа.
C-WLI-обычное изображение в белом свете;
M-NBI-увеличивающая эндоскопия с узкополосной визуализацией;
VS-сосуды плюс поверхность
Рисунок 13
(A) C-WLI не может обнаружить наличие рака, не говоря уже о границе ракового поражения.
(B) Когда мы исследуем краевую часть поражения с помощью M-NBI, мы видим отчетливые демаркационные линии (стрелки), а также нерегулярный микроваскулярный рисунок и нерегулярный рисунок микроповерхности внутри демаркационной линии. Согласно системе классификации VS, этот участок является границей, специфичной для раковой слизистой оболочки.
(C) Используя M-NBI, мы разместили метки электрокоагуляции на фоне незлокачественной слизистой оболочки сразу за демаркационной линией.
(D) Резецированный образец с картированием раковой слизистой оболочки демонстрирует, что маркировка была правильно размещена сразу за пределами раковой слизистой оболочки.
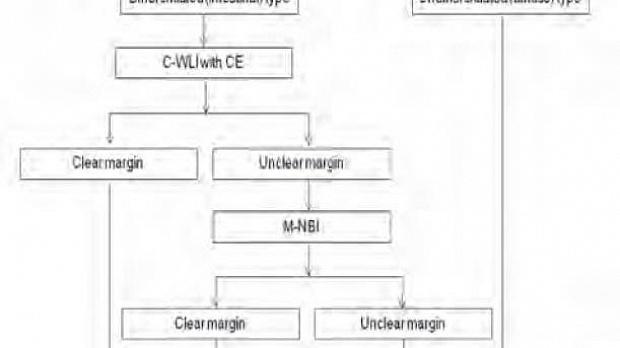
Стратегия определения латеральной степени раннего рака желудка
для лечебной эндоскопической резекции
Рисунок 14 (таблицу см.в ПДФ т.к. более качесвенное изображение получить нет возможности)
C-WLI-обычное изображение в белом свете; КЭ-хромоэндоскопия; MNBI-увеличительная эндоскопия с узкополосной визуализацией
Дифференциальный диагноз между аденомой желудка низкой степени злокачественности (LGA) и ранним раком желудка
Микрососудистый рисунок, визуализированный с помощью увеличительной эндоскопии, является надежным маркером для дифференциации доброкачественных и злокачественных плоских поражений желудка. Однако в случаях неоплазии желудка поверхностного возвышенного типа иногда невозможно визуализировать микрососудистый рисунок из-за того, что WOS скрывает субэпителиальный микрососудистый рисунок (Рис 13) [ 17 ]. Мы исследовали, может ли морфология WOS быть полезным оптическим признаком для различения аденомы и карциномы. Когда мы исследовали распространенность и морфологию WOS, визуализированную с помощью M-NBI, в соответствии с гистологическим типом (аденома против карциномы), WOS чаще присутствовал в аденомах, чем в карциномах. Кроме того, морфология WOS в 100% аденом с WOS имела регулярное распределение (Рис. 15); Напротив, 83% карцином с WOS показали нерегулярное распределение WOS (Рис.16.). Для поверхностных опухолей повышенного типа с WOS с регулярным распределением или регулярным микроваскулярным паттерном чувствительность и специфичность для дифференциации аденомы от карциномы составляли 94% и 96% соответственно. В поражениях с WOS, вместо оценки микрососудистого паттерна, морфологический анализ WOS может быть новым альтернативным визуальным маркером для дифференциации аденомы от карциномы при использовании M-NBI [ 17 , 20 , 21 ].
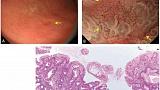
Поверхностное возвышение антрального отдела желудка (аденома низкой степени злокачественности).
C-WLI-обычное изображение в белом свете; M-NBI-увеличивающая эндоскопия с узкополосной визуализацией; WOS-белое непрозрачное вещество; VS-сосуды плюс поверхность;
МС-микроповерхность
Рисунок 15
(A) C-WLI показывает слегка приподнятое хорошо разграниченное поражение (стрелка).
(B) M-NBI показывает, что микроваскулярный паттерн не был визуализирован, потому что плотный WOS затенял субэпителиальный микроваскулярный паттерн. Морфология WOS имеет регулярный лабиринтный узор. Согласно системе классификации VS, результаты M-NBI классифицируются как отсутствие микрососудистого паттерна и обычный паттерн MS с демаркационной линией. Следовательно, это поражение диагностируется как доброкачественное поражение (аденома низкой степени злокачественности).
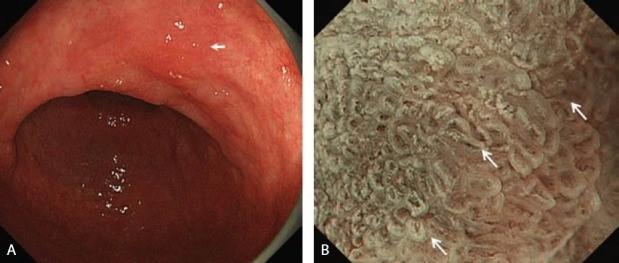
Поверхностное возвышенное поражение в нижней части желудка
(хорошо дифференцированная аденокарцинома).
C-WLI-обычное изображение в белом свете;
M-NBI-увеличивающая эндоскопия с узкополосной визуализацией;
WOS-белое непрозрачное вещество; VS-сосуды плюс поверхность;
МС-микроповерхность
Рисунок 16 (См.ПДФ)
(A) C-WLI показывает слегка приподнятое хорошо разграниченное поражение (стрелка).
(B) M-NBI показывает, что микроваскулярный паттерн не был визуализирован, потому что плотный WOS затенял субэпителиальный микроваскулярный паттерн. Морфология WOS демонстрирует неправильный пятнистый узор. Согласно системе классификации VS, результаты M-NBI классифицируются как отсутствие микрососудистого паттерна и нерегулярный паттерн MS с демаркационной линией (стрелки). Следовательно, это поражение диагностируется как раковое поражение.
Другая неоплазия желудка
Характерные результаты M-NBI для других опухолевых поражений желудка не были установлены. Тем не менее, микрокарциноидная опухоль желудка с аутоиммунным атрофическим гастритом и лимфома MALT являются относительно распространенными неопластическими заболеваниями. Поэтому в этой статье я привожу краткие характерные выводы M-NBI [23] на хороших примерах. Как показано на Рисунке 17, C-WLI показывает покрасневшее крошечное полусферическое приподнятое поражение. Когда мы наблюдаем с M-NBI, он не показывает четкой демаркационной линии и покрыт эпителием, как и окружающая фоновая слизистая оболочка при хроническом гастрите. Наиболее заметным открытием является то, что промежуточная часть, выстланная MCE, становится шире, а ее субэпителиальная капиллярная сеть (SECN) расширяется. Эти данные свидетельствуют о том, что опухолевые клетки размножаются прямо под эпителием. Соответственно, покрытый эпителий становится очень тонким, а затем расширяются SECN. Эти данные отличаются от результатов других незначительных повышенных поражений желудка, таких как рак желудка на ранней стадии, доброкачественный гиперпластический полип и подслизистая опухоль. Что касается результатов M-NBI для лимфомы MALT (Рис.18) [ 24 ], на границе поражений нет такой четкой демаркационной линии между лимфоматозной слизистой оболочкой и фоновой слизистой оболочкой. Внутри поражения результаты M-NBI показывают регулярный микроваскулярный узор с растянутой SECN, который подобен таковому на фоновой слизистой оболочке, и часто демонстрирует отсутствие микроповерхностного рисунка с отчетливо беловатым цветом. Эти находки, по-видимому, связаны с гистологической архитектурой плотного роста лимфоматозных клеток прямо под поверхностным эпителием. Поскольку сами клетки лимфомы происходят не из эпителия, а из стромальной ткани, они вряд ли образуют четкую демаркационную линию на границе поверхностного эпителия.
Эндоскопические данные о микрокарциноидной опухоли на большой кривизне тела желудка.
C-WLI-обычное изображение в белом свете;
M-NBI-увеличительная эндоскопия с узкополосной визуализацией
Рисунок 17
(A) C-WLI показывает покрасневшее полусферическое приподнятое поражение.
(B) M-NBI показывает регулярный рисунок микрососудов и правильный рисунок микроповерхности с расширенными промежуточными частями.
Нет четкой демаркационной линии между поражением и фоновой слизистой оболочкой.
MALT-лимфатическая ткань, связанная со слизистой оболочкой;
C-WLI-обычное изображение в белом свете
Рисунок 18
(A) Эндоскопические данные о MALT-лимфоме на большой кривизне тела желудка.
(B) C-WLI показывает слегка приподнятое поражение с гладкой поверхностью.
Выводы
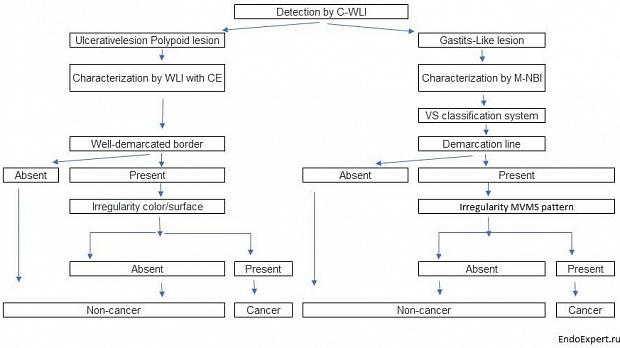
На основе нашей серии исследований мы разработали стратегию эндоскопической диагностики раннего рака желудка, как показано на Рисунок 19[ 25 ].
В заключение я хотел бы подчеркнуть, что нам необходимо ознакомиться с основными принципами, во-первых, для обнаружения и, во-вторых, для характеристики, используя как обычную эндоскопию, так и современные эндоскопические методы. В ближайшем будущем нам необходимо стандартизировать процедуры и разработать систему обучения, широко приемлемую для эндоскопистов во всем мире. Таким образом, мы сможем снизить смертность от рака желудка, который является второй ведущей причиной смертности от рака во всем мире [ 26 ].
Благодарности
Мы хотим поблагодарить доктора Марка Престона (Access Medical Communications, Виктория, Австралия) за исправление английского языка, используемого в этой рукописи, а также доктора Шоко Фудзивару и доктора Кентаро Имамуру за сбор эндоскопических изображений.
Эта работа была поддержана грантом на научные исследования (C) Японского общества содействия науке (# 21590882) и фондами Центрального исследовательского института Университета Фукуока (I) и Центрального исследовательского института Университета Фукуока для эндоскопии.
Стратегия эндоскопической диагностики раннего рака желудка
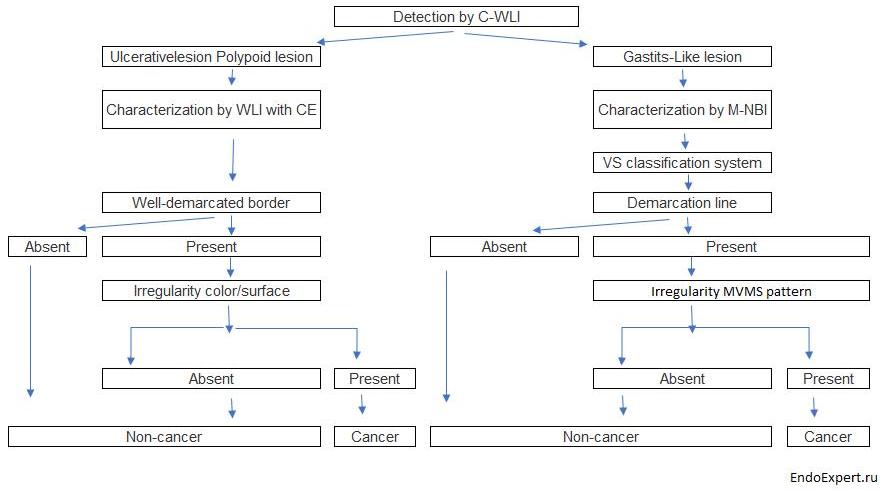
Рисунок 19
C-WLI-обычное изображение в белом свете; КЭ-хромоэндоскопия;
M-NBI-увеличивающая эндоскопия с узкополосной визуализацией;
VS-судно плюс поверхность; МВ-микрососудистая сеть;
МС-микроповерхность
Список литературы:
In: Tada M, Maruyama M and Fujino M (ed) I to Cho Handbook.
Igakushoin, Tokyo, 1992, pp 132-139.
2. The committee for standardizing screening gastroscopy. Gastric
cancer screeing teichniques. In: JSGCS (ed) I to Cho Handbook.
Igakushoin, Tokyo 2010, pp 1-24.
3. Rey JF, Lambert R; ESGE Quality Assurance Committee.
findings show regular a microvascular pattern with distended
SECN which is similar to that of the background mucosa
and it often demonstrates absent microsurface pattern with
a distinctly whitish color. These findings seem to originate
in the histological architecture of the dense lymphomatous
cell growth just underneath the surface epithelium. Since the
lymphoma cells themselves are not from epithelial origin but
stromal tissue, they are not likely to form a clear demarcation
line at the border of surface epithelium.
22 K. Yao
Annals of Gastroenterology 26
ESGE recommendations for quality control in gastrointestinal
endoscopy: guidelines for image documentation in upper and
lower GI endoscopy. Endoscopy 2001;33:901-903.
4. The JL, Hartman M, Lau L, et al. Duration of Endoscopic
Examination Significantly Impacts Detection Rates of Neoplastic
Lesions During Diagnostic Upper Endoscopy. Gastrointest Endosc
2011;73(4S): AB393.
5. Yagi K, Nakamura A, Sekine A. Comparison between magnifying
endoscopy and histological, culture and urease test findings from
the gastric mucosa of the corpus. Endoscopy 2002;34:376-381.
6. Anagnostopoulos GK, Yao K, Kaye P, et al. High-resolution
magnification endoscopy can reliably identify normal gastric
mucosa, Helicobacter pylori-associated gastritis, and gastric
atrophy. Endoscopy 2007;39:202-207.
7. Uedo N, Ishihara R, Iishi H, et al. A new method of diagnosing
gastric intestinal metaplasia: narrow-band imaging with
magnifying endoscopy. Endoscopy 2006;38:819-824.
8. Kanzaki H, Uedo N, Ishihara R, et al. Comprehensive investigation
of areae gastricae pattern in gastric corpus using magnifying
narrow band imaging endoscopy in patients with chronic atrophic
fundic gastritis. Helicobacter 2012;17:224-231.
9. Dinis-Ribeiro M, Areia M, de Vries AC, et al. Management of
precancerous conditions and lesions in the stomach (MAPS):
guideline from the European Society of Gastrointestinal Endoscopy
(ESGE), European Helicobacter Study Group (EHSG), European
Society of Pathology (ESP), and the Sociedade Portuguesa de
Endoscopia Digestiva (SPED). Endoscopy 2012;44:74-94.
10. Yagi K, Nakamura A, Sekine A. Endoscopic features of the normal
gastric mucosa without Helicobacter pylori infection [in Japanese
with English abstract]. Gastroenterol Endosc 2000;10:1977-1987.
11. Gotoda T, Shimoda T, Fujishiro M, et al. Macroscopic feature of
“gastritis-like cancer” with little malignant appearance in early
gastric cancer (Japanese with English abstract). Stomach Intestine
(Tokyo) 1999;34:1495-1503.
12. Kaltenbach T, Sano Y, Friedland S, Soetikno R; American
Gastroenterological Association. American Gastroenterological
Association (AGA) Institute technology assessment on image-
enhanced endoscopy. Gastroenterology 2008;134:327-340.
13. Yao K, Takaki Y, Matsui T, et al. Clinical application of
magnification endoscopy and narrow-band imaging in the upper
gastrointestinal tract: new imaging techniques for detecting and
characterizing gastrointestinal neoplasia. Gastrointest Endosc
Clin N Am 2008;18:415-433, vi-viii.
14. Yao K, Anagnostopoulos GK, Ragunath K. Magnifying endoscopy
for diagnosing and delineating early gastric cancer. Endoscopy
2009;41:462-467.
15. Yao K, Iwashita A, Kikuchi Y, et al. Novel zoom endoscopy
technique for visualizing the microvascular architecture in gastric
mucosa: a new diagnostic endoscopic system for early gastric
cancer. Clin Gastroenterol Hepatol 2005;3:S23-S26.
16. Yao K, Iwashita A, Tanabe H, et al. Novel zoom endoscopy
technique for diagnosis of small flat gastric cancer, a prospective,
blind study. Clin Gastroenterol Hepatol 2007;5:869-878.
17. Yao K, Iwashita A, Tanabe H, et al. White opaque substance
within superficial elevated gastric neoplasia as visualized by
magnification endoscopy with narrow-band imaging: a new
optical sign for differentiating between adenoma and carcinoma.
Gastrointest Endosc 2008;68:574-580.
18. Ezoe Y, Muto M, Uedo N, et al. Magnifying narrowband imaging is
more accurate than conventional white-light imaging in diagnosis
of gastric mucosal cancer. Gastroenterology 2011;141:2017-2025.
19. Nagahama T, Yao K, Maki S, et al. Usefulness of magnifying
endoscopy with narrow-band imaging for determining the
horizontal extent of early gastric cancer when there is an unclear
margin by chromoendoscopy (with video). Gastrointest Endosc
2011;74:1259-1267.
20. Miwa K, Doyama H, Ito R, et al. Can magnifying endoscopy
with narrow band imaging be useful for low grade adenomas in
preoperative biopsy specimens? Gastric Cancer 2012;15:170-178.
21. Maki S, Yao K, Nagahama T, et al. Magnifying endoscopy with
narrow-band imaging is useful in the differential diagnosis
between low-grade adenoma and early cancer of superficial
elevated gastric lesions. Gastric Cancer 2012 (in press)
22. Yao K. Chapter 8. Which microanaltomies are visualized by
magnifying endoscopy with NBI and how is this achieved? In:
Yao K (ed) Zoom Endoscopy. Nihon Medical Center, Tokyo,
2009, pp 75-106.
23. Singh R, Yao K, Anagnostopoulos G, et al. Microcarcinoid tumor
diagnosed with high-resolution magnification endoscopy and
narrow band imaging. Endoscopy 2008;40(Suppl 2):E12.
24. Ono S, Kato M, Ono Y, et al. Characteristics of magnified
endoscopic images of gastric extranodal marginal zone B-cell
lymphoma of the mucosa-associated lymphoid tissue, including
changes after treatment. Gastrointest Endosc 2008;68:624-631.
25. Yao K. How is the VS (vessel plus surface) classification system
applicable to magnifying narrow-band imaging examinations of
gastric neoplasias initially diagnosed as low-grade adenomas?
Gastric Cancer 2012;15:118-120.
26. Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of
cancer in 2008: GLOBOCAN 2008. Int J Cancer 2010;127:2893-2917.
Статьи по теме
Рекомендуемые статьи
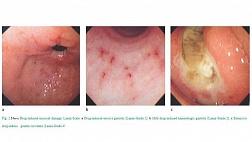
Эластография при эндосонографии (ЭУС или эндоУЗИ)
Эластография (эластосонография) – метод виртуальной пальпации (технология улучшенной визуализации при ЭУС диагностике), позволяющий дифференцировать злокачественные и доброкачественные поражения лимфоузлов. Основана на принципе, что более мягкие ткани при сжатии легче деформируются, это позволяет объективно оценить консистенцию ткани, показать различия в плотности между нормальными и патологически измененными тканями.
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.






.jpg)




.png)

















Комментарии