- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Эндоскопическое лечение раннего рака пищевода и желудка
| Авторы: | Vanessa M. Shami, MD, Irving Waxman, MD 2002г. |
Введение:
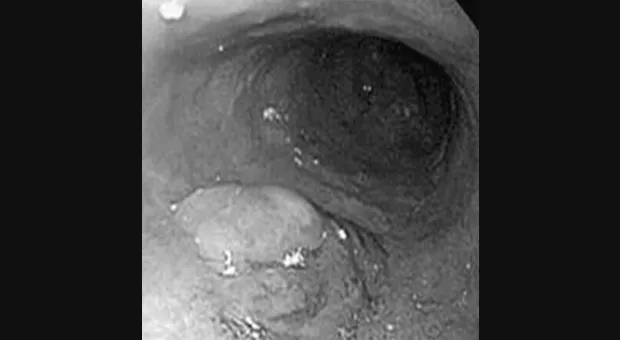
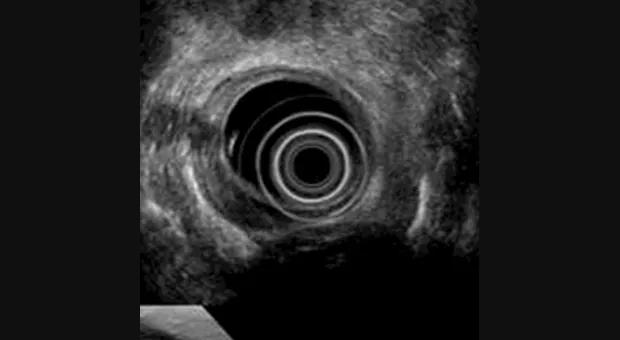
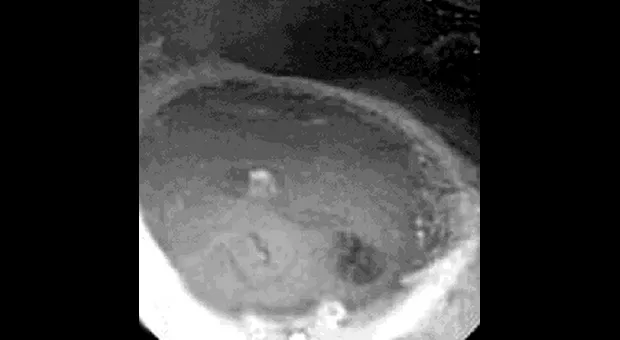

Полный текст статьи:
Определение раннего рака пищевода и желудка
При лечении раннего рака желудка и пищевода с использованием эндоскопических методов очень важно понимать, что скрывается под словом "ранний". Применяемая в настоящее время в США система стадирования рака пищевода и желудка TNM заостряет внимание на глубину инвазии опухоли (Т), вовлечение лимфатических узлов (N) и наличие метастазов (М). Уровень пятилетней выживаемости варьирует в зависимости стадии по ТNМ. Рак ограниченный слизистой чаще всего не имеет метастазов в лимфатические узлы, однако рак с вовлечением подслизистого слоя дает такие метастазы в 30 % случаев [1]. Следовательно, опухоли ограниченные слизистой могут удаляться эндоскопически и служить альтернативой хирургической резекции.
Обсуждение методов ранней диагностики
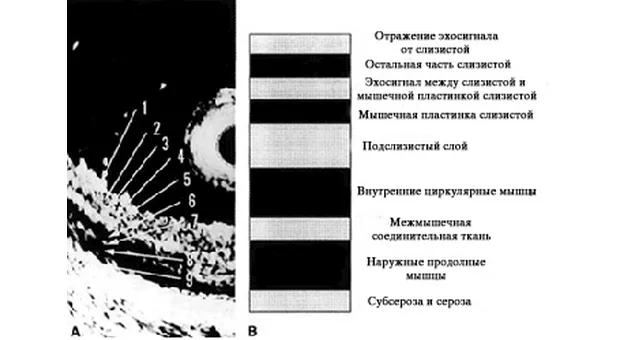
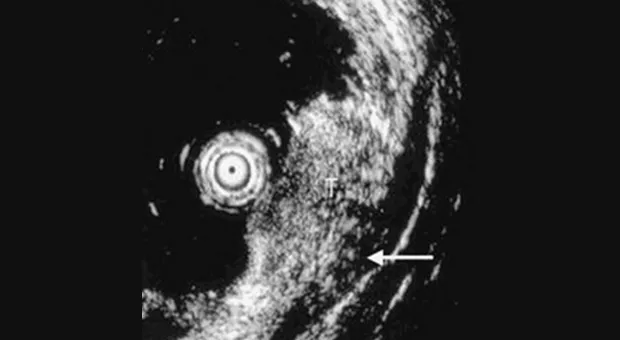
Эндоскопическое УЗИ
Правильное установление стадии развития опухоли необходимо для выбора приемлемого метода лечения. С развитием эндоскопического УЗИ увеличилась его точность определения глубины инвазии опухоли (Т). Kelly с соавторами [2] объединил результаты 27 статей посвященных эндоскопическому УЗИ в определении стадии рака пищевода и желудка по TNM и пришел к выводу, что эндоскопическое УЗИ имеет высокую степень точности в установлении стадии заболевания.
Caletti с коллегами [3] сообщают, что точность эндоскопического УЗИ в установлении стадии достигает 80 % по Т и около 77 % по N. В последнем опубликованном обзоре [4] точность установления стадии рака желудка варьировало от 67 % до 92 %. Согласно данных представленных Murata с коллегами [5] чувствительность и специфичность определения инвазии с мышечную пластинку слизистой оболочки при использовании зонда с частотой 20-MHz была 97 % и 87 % соответственно. В дополнение к этому, по данным крупнейшего Американского исследования по резекции слизистой [6], наблюдается высокий уровень совпадения между данными полученными при высокочастотном ультразвуковом сканировании и морфологическими находками (96 %).
Хромоэндоскопия
Не менее важно определение границ распространения опухоли. Методы выявления и определения границ опухоли включают хромоэндоскопию и эндоскопическую флюоресценцию. Раствор Люголя используется для выявления плоскоклеточного рака пищевода [7,8]. Он временно окрашивает нормальный эпителий в темно-коричневый цвет, за счет реакции с богатыми гликогеном клетками. Следовательно, патологические, бедные гликогеном клетки остаются неокрашенными и протяженность поражения становиться ясной. В Японских и Бразильских клиниках [8,9,10] применяли окраску люголем у 60 пациентов с раком головы и шеи. У пятерых из них (8,3 %) был выявлен поверхностный рак пищевода (только один из них был виден эндоскопически) и еще у пятерых (8,3 %) - дисплазия эпителия. В настоящее время хромоэндоскопия используется для определения распространенности процесса, но данных для ее применения при рутинной эндоскопии недостаточно. В настоящее время отсутствует эффективное средство селективно окрашивающее аденокарциному пищевода и желудка. Данные по использованию метеленовой синьки для окрашивания пищевода Баррета и индигокармина для окраски желудка противоречивы [11,14].
Флюоресцентная эндоскопия
Количество литературы посвященной эндоскопической флюоресценции в диагностики дисплазии и злокачественных поражений пищевода продолжает расти. Mayinger с коллегами [15] назначал в качестве фотосенсибилизатора 5-аминолевулиновую кислоту (5-ALA) перорально 22 пациентам с уже установленным злокачественным или предраковым поражением пищевода. У 6 пациентов был пищевод Баррета, у 6 - ранний плоскоклеточный рак или аденокарцинома пищевода (T1N0M0) и у одного была более далеко зашедшая аденокарцинома пищевода (T3N1). В дополнение к этому 9 пациентов после радикального лечения рака пищевода так же прошли фотодинамическую диагностику. При биопсии 85 % подозрительных участков выявленных при флуоресцентной эндоскопии демонстрировали предраковые и злокачественные изменения, в то время как для обычной эндоскопии эта цифра равнялась 25 %. Наблюдалось достаточно большое количество ложноположительных результатов в участках воспаления или регенерации слизистой. Та же группа исследователей сообщала о высокой степени чувствительности и специфичности при использовании светоиндуцируемой аутофлуоресцентной спектроскопии [16]. Endlicher с коллегами [17] использовал 5-ALA для выявления дисплазии у пациентов с пищеводом Баррета. Он обследовал 47 пациентов, у 10 из которых наличие дисплазии было уже известно. Было проведено 58 эндоскопических флуоресцентных исследований после введения различных концентраций 5-ALA (5, 10, 20, 30 мг/кг) или нанесения 5-ALA непосредственно на слизистую. Исследователи так же провели 243 биопсии флюоресцирующих и не флюоресцирующих областей. Чувствительность при системном введении 5-ALA (20-30 мг/кг) была 100 %. Однако специфичность (70 %) была выше при местном нанесении. Эта процедура дорога и требует специальной аппаратуры. Изученные группы малы и проведение дальнейших исследований кажется оправданным.
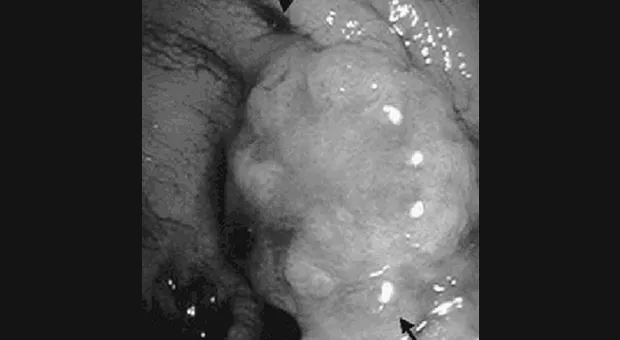
Эндоскопическая резекция слизистой (EMR)
Техника EMR была разработана Японскими ученными для лечения поверхностных видов рака. Ее большим преимуществом является возможность получения целого образования для последующего морфологического исследования. После определения зоны поражения с использованием эндоскопического УЗИ и хромоскопии/флюоресценции образование приподнимается путем подслизистого введения физиологического раствора с или без эпинефрина. Некоторые исследователи отстаивают использование для подслизистого введения мукополисахарида из-за его более медленной диффузии [18]. В пищеводе достаточно введение 5 мл раствора, в желудке и толстой кишке обычно требуется больше [19]. Отсечение на уровне подслизистого слоя проводится с помощью прозрачной насадки, эндоскопической трубки для резекции слизистой пищевода или двухканального эндоскопа [20]. Цельный препарат затем извлекается для морфологического исследования. Осложнения включающие кровотечение, перфорацию и эмфизему встречаются в 3-13 % случаев [21. К счастью, осложнения в большинстве случаев могут быть пролечены эндоскопически.
Важность установления стадии
Вовлечение лимфатических узлов непосредственно связанно со стадией Т поражения. Folli с коллегами [22] провел мультицентрическое многоцентровое ретроспективное исследование 584 пациентов с ранним раком желудка перенесших гастрэктомию D1. Только 3,7 % с поражением ограниченным слизистой имели метастазы в лимфатические узлы, тем временем как при вовлечении подслизистого слоя метастазы наблюдались в 25,3 %. Shimada с коллегами [23] провел ретроспективное обследование 1051 пациентов с ранним раком желудка перенесших гастрэктомию с диссекцией лимфатических узлов по D1 или D2. Частота метастазов в лимфатические узлы была 2,3 % для опухолей ограниченных слизистой и 19,8 % при вовлечении подслизистого слоя. Опухоли, ограниченные слизистой оболочкой, имевшие метастазы в лимфатические узлы были изъязвлены. Авторы сделали вывод, что все пациенты с опухолью ограниченной слизистой оболочкой и без изъязвления должны рассматриваться как кандидаты на EMR. Кроме характера поверхности опухоли важны границы от краев препарата до опухолевых клеток [24]. Японские исследователи показали [25], что уровень рецидива равен 0 % при границе 2 мм и более, 20 % при границе менее 2 мм и 50 % когда в краях препарата присутствуют опухолевые клетки.
Согласно решению Японской Ассоциации Гастроинтестинальной Эндоскопии абсолютным показанием к EMR является поверхностный рак пищевода типа IIa, IIb, или IIc, размер опухоли менее 2 см и интроэпителиальный рак - m1 рак. Для раннего рака желудка опухоль должна быть приподнятого типа (I или IIа), ограничена слизистой, хорошо дифференцированной и менее 2 см размером при типе I и хорошо дифференцированной, менее 1 см размером и без изъязвления при типе IIa. По более широким показаниям к резекции слизистой консенсус не достигнут [26].
Пищевод
Fujita с коллегами [27] изучил 150 пациентов с поверхностным плоскоклеточным раком пищевода перенесших EMR или эзофагэктомию. Из 72 пациентов имевших опухоль ограниченную слизистой оболочкой 35 пациентов подверглись EMR, а 37 - эзофагэктомии. Уровень осложнений и смертности у пациентов после EMR был ниже чем после эзофагэктомии (7 % на 69 % и 0 % на 14 % соответственно). Длительной выживаемости при EMR был таков же как и эзофагэктомии. Анализ показал, что длительность выживаемости не зависнет от вида лечения - резекция слизистой или эзофагэктомия, у пациентов с опухолью ограниченной слизистой оболочкой.
Takeo коллегами [28] изучил использование трубки для EMR у 29 пациентов с раком пищевода ограниченным слизистой (27 больных с 33 очагами поражения) или дисплазией (2 больных с двумя очагами поражения). Двадцать из 35 патологических очагов были резецированы единым блоком, а 15 были удалены методом кускования. У 10 пациентов с 15 очагами поражения был диагностирован рак типа m3 или его более инвазивные типы, 5 пациентов этой группы были прооперированны. Из оставшихся 24 больных не один не умер от рака пищевода при средних сроках наблюдения 30,9 - 18,9 месяцев. Четырехлетняя выживаемость в группе EMR была 100 % при опухолях типа m1- m2, 75 % при опухолях типа m3 и 100 % в группе перенесших хирургическое вмешательство.
Buttar коллегами [29] скомбинировали EMR и фотодинамическую терапию у пациентов с раком пищевода развившимся из пищевода Баррета. Семнадцать пациентов с доказанной Т1 стадией поражения подверглись резекции слизистой с последующей фотодинамической терапии через 4 недели, которая при необходимости повторялась. У 16 пациентов наблюдалась гистологическая и клиническая ремиссия в средние сроки наблюдения равные 13 месяцев. Один пациент был прооперирован из-за наличия инвазивной опухоли.
Поражения желудка
Ono с коллегами [30] выполнил EMR у 445 пациентов с поверхностными поражениями желудка. При патологическом процессе ограниченном слизистой оболочкой полноценная резекция (т.е. когда края препараты были свободны от патологических клеток) была выполнена в 69 % (278/405), в то время как резекция была неполной в 31 % случаев (127/405). Уровень рецидива составил 2 % и 17 % соответственно. Не наблюдалось смерти связанной с раком желудка при наблюдении средней длительности в 38 месяцев. Во всех случаях рецидива проводились радикальные вмешательства.
Yoshikane с сотрудниками [31] исследовал возможность выполнения эндоскопической аспирационной резекции слизистой кускованием для поверхностных внутрислизистых опухолей желудка большего размера. У всех пяти пациентов был рак желудка размером 4 или более см (средний размер 4,8 см). Была выполнена эндоскопическая аспирационная резекция слизистой кускованием с помощью панэндоскопа с насадкой. За время наблюдения в течение 16,4 ± 1,1 месяца у одного пациента была выявлена остаточная опухоль (или ее рецидив), у 4 опухоли не наблюдалось.
Suzuki с коллегами [32] недавно разработал новую эндоскопическую технику включающую эндоскопическую резекцию "во всю толщу" и полное эндоскопическое закрытие дефекта в лечении одного поражения ДПК и двух случаев карцинойда прямой кишки. Метод дает возможность выполнить более широкую и глубокую резекцию. В дополнении к этому было продемонстрировано, что EMR с помощью высокочастотного зонда и под контролем эндоскопического УЗИ может с успехом использоваться для удаления маленьких подслизистых опухолей ЖКТ [33].
Процедуры основанные на абляции
Эндоскопические процедуры основанные на абляции включают фотодинамическую терапию, электрокоагуляцию (аргоновую плазменную коагуляцию [APC] и мультиполярную электрокоагуляцию) и лазеротерапию. Эффективность большинства этих методов для паллиативного лечения доказано, но увеличивается и их использование в лечении раннего рака верхних отделов ЖКТ.
Фотодинамическая терапия
Пациентам вводится фотосенсибилизирующий агент накапливающийся преимущественно в раковых клетках. Затем вводится световод лазера с определенной длинной волны, свет которого активирует веденное вещество, накопившееся в патологических клетках, и вызывает формирование в них свободных радикалов и их разрушение. Фотодинамическая терапия была применена для экспериментального лечения раннего плоскоклеточного рака пищевода и предраковых изменениях при пищеводе Баррета [34].
Первыми примененными фотосенсибилизаторами были производные гематопорфирина [35]. Эндоскопия выполнялась через 2-3 дня после внутривенного введения, когда разница в концентрации вещества в опухолевых и нормальных клетках, как полагали, достигала пика. Только фотофрин, являющийся наиболее очищенной формой препарата, одобрен Администрацией по контролю пищевых и лекарственных продуктов США для использования в лечении поражений пищевода. Основным его недостатком является длительный период (60-90 дней) фотосенсибилизации кожи. Новым, испытываемым в настоящее время фотосенсибилизатором является 5-ALA. Она назначается перорально за 4-6 часов до выполнения эндоскопии и длительность кожной фотосенсибилизации при ее применении ограничивается двумя днями.
Radu с коллегами [35] проанализировал результаты фотодинамического лечения 164 пациентов (из 11 исследований) с поверхностным плоскоклеточным раком пищевода. Полный ответ наблюдался у 50-100 % пациентов при сроках наблюдения 1-96 месяцев. Тяжелые осложнения как формирование свища, перфорация и стеноз наблюдались у 20 пациентов (12,2 %) из 164.
Ackroyd с коллегами [36] в случайном порядке распределил 36 пациентов с пищеводом Баррета и дисплазией на получение 5-ALA или плацебо. В группе получавшей фотодинамическую терапию дисплазии в цилиндрическом эпителии при наблюдении через 6, 12 и 24 месяца выявлено не было. В группе плацебо у 12 из 18 пациентов продолжала наблюдаться дисплазия низкой степени. Overholt с коллегами [37] использовал фотодинамическую терапию для лечения 100 пациентов с пищеводом Баррета и дисплазией высокой степени или поверхностным раком. Реэпителизация плоским эпителием произошла в 75-80 % случаев с полным исчезновением слизистой характерной для пищевода Баррета у 43 пациентов. Дисплазия была устранена у 78 пациентов, и рак был устранен у 10 из 13 пациентов. Overholt с коллегами [37] так же провел другое исследования у больных с пищеводом Баррета и дисплазией высокой степени. Он в случайном порядке распределил их на получение омепразола (в дозе 20 мг 2 раза в день) в сочетании с фотодинамической терапией (138 человек) или только на омепразол (70 человек). Пациенты в группе фотодинамической терапии получали не более 3 курсов. При сроке наблюдения в 6 месяцев исчезновение дисплазии высокой степени наблюдалось значительно чаще в группе получавших фотодинамическую терапию, чем у пациентов принимавших только омепразол (80 % на 40 %). Более того, при осмотре через год среди пациентов первой группы наблюдалось меньше случаев прогрессирования заболевания. Gossner с коллегами [39] сообщил об использовании фотодинамической терапии с использованием 5-ALA у 32 пациентов с дисплазией высокой степени или раке пищевода. Дисплазия была устранена у всех 10 пациентов и поверхностная карцинома была устранена у 17 (77 %) из 22 пациентов, при среднем сроке наблюдения в 10 месяцев.
Отсутствуют проспективные исследования, непосредственно сравнивающие различные фотосенсибилизаторы при раке пищевода. Maier с коллегами [40] сообщал о более успешном уменьшении дисфагии, стеноза и улучшении общего самочувствия при использовании производных гематопорфирина по сравнению с 5-ALA. Существуют сообщения о возможной персистенции генетических нарушений, несмотря на фенотипическое улучшение дисплазии после фотодинамической терапии [41]. Необходимы дополнительные исследования.
Электрокоагулиция: аргоновая плазменная коагуляция и мультиполярная электрокоагуляция
Данные по электрокоагуляции ограничены ее использованием при пищеводе Баррета. Исследования не рандомизированны и не поддаются сравнению. До одобрения использования электрокоагуляции необходимо ответить на несколько вопросов: может ли достигнута реэпителизация эпителия характерного для пищевода Баррета плоским эпителием; если да то устраняет ли это риск развития аденокарциномы в группе пролеченных пациентов; имеют ли эти вопросы такой же ответ у пациентов с дисплазией или карциномой in situ?
Аргоновый плазменный коагулятор это бесконтактное термическое устройство, недорогое и простое в использовании, которое иногда применяется при пищеводе Баррета. В одном исследовании включавшим 31 пациента [42], в 61 % случаев была достигнута полная гистологическая эрадикация после в среднем 2,4 сеанса APC. Однако, через год только 9 из 17 пациентов не имели метапластических тканей. В другом исследовании [43] реэпителизация плоским эпителием была достигнута в 100 % случаев после в среднем 2,4 сеансов APC. Однако в 30 % случаев оставались участки лежащей под слоем плоского эпителия кишечной метаплазии. Mork с коллегами [44] использовали APC у 15 пациентов с пищеводом Баррета, в среднем в количестве 3х сеансов. У 13 пациентов наблюдалось полное восстановление плоского эпителия, однако, у одного затем произошел рецидив пищевода Баррета. Grade с коллегами [45] выполнили интересное исследование, в котором одна половина окружности занимаемой эпителием пищевода Баррета лечилась с использованием APC, а ее вторая часть использовалась как зона контроля. У 9 из 10 пациентов прошедших все стадии исследования в среднем требовалось 1,7 сеанса APC для достижения реэпителизации плоским эпителием областей подвергавшихся лечению. Однако у 2 из 9 (22,2 %) наблюдалась подлежащая кишечная метаплазия.
Остаточная подлежащая кишечная метаплазия связывается с ограниченной глубиной проникновения APC (3 мм). Для преодоления этой проблемы Pereira-Lima с коллегами [46] использовали более мощное воздействие (от 65 до 70 W) APC у 33 пациентов с пищеводом Баррета, у 14 из которых была дисплазия низкой степени, а у одного дисплазия высокой степени. Полная реэпителизация плоским эпителием была достигнута в 100 % случаев после, в среднем, 1,96 сеанса. При средних сроках наблюдения в 10,6 месяца наблюдался только один случай рецидива пищевода Баррета. Однако количество осложнений было высоким и у 19 пациентов (57, 5 %) наблюдалась боль в груди средней/тяжелой интенсивности и одинофагия. У 5 из этих пациентов была лихорадка и небольшой плевральный выпот, у 3 развились стриктуры, а у одного пневмомедиастеум. Schultz с коллегами [47] получили лучшие результаты. Из 70 пациентов получивших полный курс лечение APC (90 W) по поводу пищевода Баррета, у 69 (98, 6 %) достигнута полная регенерация плоского эпителия после, в среднем, 2 сеансов APC и средних сроках наблюдения в 12 месяцев.
Данных об успешном использовании APC в лечении рака возникшего из пищевода Баррета недостаточно. Есть данные [48] о 3 случаях рака абляция которых была достигнута за 1-2 сеанса. В течении средних сроков наблюдения в 24,3 месяца наблюдался один рецидив, который был в последующим пролечен фотодинамической терапией. Достаточно недавно Van Laethem с коллегами [49] обследовали 10 пациентов с дисплазией высокой степени или раком in situ подвергшихся в среднем 3,3 сеансам APC. У 8 из 10 при средних сроках наблюдения в 24 месяца рецидива не наблюдалось. У одного пациента с дисплазией высокой степени она сохранилась, у другого прогрессировала в инвазивный рак.
Мультиполярная электрокоагуляция
Sampliner коллегами [50] использовали мультиполярную электрокоагуляцию у 10 пациентов для лечения половины окружности занятой пищеводом Баррета. На момент публикации их данных у всех 10 пациентов наблюдалась полная элиминация пищевода Баррета на участках подвергшихся лечению (в среднем 2,5 сеанса). Sharma коллегами [51] пролечил мультиполярной коагуляцией 11 пациентов, причем потребовалось в среднем 9,5 сеансов для достижения полной реверсии слизистой пищевода Баррета. При средних сроках наблюдения в 24 месяца у 3 из 11 имелась кишечная метаплазия под вновь образовавшимся плоским эпителием. Наиболее крупное и новое мультицентровое исследование было проведено Sampliner коллегами [52]. В нем 72 пациента были пролечены с использованием мультиполярной коагуляции. У 8 пациентов не было выявлено пищевода Баррета, еще у 8 реверсия не была достигнута через 6 сеансов терапии. У 54 (78 %) из оставшихся 58 достигнута полная реверсия пищевода Баррета после, в среднем, 3,5 сеансов. Существуют свидетельства указывающие, что уменьшение толщины стенки пищевода при эндоскопическом УЗИ у пациентов после мультиполярной электрокоагуляции ассоциированно с гистологическим отсутствием кишечной метаплазии [53].
Данные об использовании электрокоагуляции в качестве самостоятельного способа лечения рака отсутствуют. Sharma коллегами [54] использовал комбинацию неодим: иптрий-алюминий-гранатового (Nd:YAG) лазера и мультиполярной электрокоагуляции у пациентов с очагом аденокарциномы в пищеводе Баррета, отказавшихся от операции или имеющих противопоказания. У одного пациента, постоянно получающего иммунносупрессивную терапию, развился рецидив после 36 месяцев наблюдения. У трех пациентов сохранялась кишечная метаплазия при средних сроках наблюдения в 3,4 года.
При отсутствии проспективных данных, что реэпителизация пищевода уменьшает частоту аденокарциномы и при высоком уровне остаточной кишечной метаплазии сохраняющейся несмотря на терапию эндоскопическое наблюдение остается необходимым. Дальнейшие исследования APC и мультиполярной электрокоагуляции при пищеводе Баррета являются оправданными.
Лазеры
Содово-титановый-фосфатный (KTP) лазер это Nd:YAG лазер с удвоенной частотой с длинной волны 532 нм. Его использование ограничено пищеводом Баррета. Barham коллегами [55] использовали абляцию с помощью KTP лазера у 16 пациентов с пищеводом Баррета без дисплазии. Несмотря на то, что в среднем применялось три сеанса, у большинства пациентов (11 из 13) была обнаружена подлежащая кишечная метаплазия. Biddlestone коллегами [56] получили сходные результаты при использовании KTP лазера у 10 пациентов. Из 24 биоптатов взятых с макроскопически выглядящей как покрытая плоским эпителием слизистой, имели признаки 11 остаточной слизистой пищевода Баррета. Gossner коллегами [57] использовали абляцию с помощью KTP лазера (в среднем 2,4 сеанса) у 10 пациентов с пищеводом Баррета и дисплазией (у 8 из них) или аденокарциномой (2 человека). После наблюдения в среднем 10,6 месяца у 2 сохранялась резидуальная кишечная метаплазия, но дисплазия или рак выявлены не были.
Было опубликовано небольшое количество исследований посвященных использованию Nd:YAG лазера при пищеводе Баррета. Salo коллегами [58] имели определенного успеха в достижении полной реэпителизации плоским эпителием у 11 пациентов подвергшихся абляции пищевода Баррета Nd:YAG лазером после антирефлюксной операции.
Криотерапия
Существуют ограниченные данные об использовании криотерапии на животных моделях. Pasricha коллегами [59] создали катетер позволяющий бесконтактно доставить жидкий азот через эндоскоп. Используя в качестве модели собак, он применял криотерапию в пищеводе. Последующее гистологическое исследование демонстрировало полную реэпителизацию за 3 недели. Используя в качестве модели свиней [60] было продемонстрирована возможность применения этого способа в дистальной части пищевода. Однако применение криотерапии к всех окружности пищевода привела к образованию стриктур в 3 из 11 случаев.
Вывод:
Список литературы:
- Caletti G, Fusaroli P, Bocus P: Endoscopic ultrasonography. Endoscopy 1998,30:198-221.
- Kelly S, Harris KM, Berry E, et al.: A systemic review of the staging performance of endoscopic ultrasound in gastro-oesophageal carcinoma. Gut 2001,49:534-539.
- Caletti G, Fusaroli P, Bocus P: Endoscopic ultrasonography. Endoscopy 1998,30:198-221.
- Messmann H, Schlottmann K: Role of endoscopy in the staging of esophageal and gastric cancer. Semin Surg Oncol 2001,20:78-81.
- Murata Y, Suzuki S, Mitsunaga A, et al.: Endoscopic ultrasound in diagnosis and mucosal resection for early esophageal cancer. Endoscopy 1998,30:A44-A46.
- Waxman I, Saitoh Y: Clinical outcome of endoscopic mucosal resection for superficial GI lesions and the role of high-frequency US probe sonography in an American population. Gastrointest Endosc 2000,52:322-327.
- Takeo Y, Yoshida T, Shigemitu T, et al.: Endoscopic mucosal resection for early esophageal cancer and esophageal dysplasia. Hepatogastroenterology 2001,48:453-457.
- Kozarek R, Inoue H, Sakai P, et al.: Lugol chromoendoscopy for esophageal squamous cell cancer. Endoscopy 2001,33:75-79.
- Fagundes RB, de Barros SG, Putten AC, et al.: Occult dysplasia is disclosed by Lugol chromoendoscopy in alcoholics at high risk for squamous cell carcinoma of the esophagus. Endoscopy 1999,31:281-285.
- Tincani AJ, Brandalise N, Altemani A, et al.: Diagnosis of superficial esophageal cancer and dysplasia using endoscopic screening with a 2% Lugol dye solution in patients with head and neck cancer. Head Neck 2000,22:170-174.
- Wong RK, Horwhat JD, Maydonovitch BS: Sky blue or murky waters: the diagnostic utility of methylene blue. Gastrointest Endosc 2001,54:409-413.
- Canto MI: Methylene blue chromoendoscopy for Barrett's esophagus: coming soon to your GI unit? Gastrointest Endosc 2001,54:403-409.
- Kiesslich R, Hahn M, Herrmann G, et al.: Screening for specialized columnar epithelium with methylene blue: chromoendoscopy in patients with Barrett's esophagus and a normal control group. Gastrointest Endosc 2001,53:47-52.
- Sharma P, Topalovski M, Mayo MS, et al.: Methylene blue chromoendoscopy for detection of short-segment Barrett's esophagus. Gastrointest Endosc 2001,54:289-293.
- Mayinger B, Neidhardt MS, Holger R, et al.: Fluorescence induced with 5-aminolevulinic acid for the endoscopic detection and follow-up of esophageal lesions. Gastrointest Endosc 2001,54:572-578.
- Mayinger B, Horner P, Jordan M, et al.: Light-induced autofluorescence spectroscopy for the endoscopic detection of esophageal cancer. Gastrointest Endosc 2001,54:195-201.
- Endlicher E, Knuechel R, Hauser T, et al.: Endoscopic fluorescence detection of low and high grade dysplasia in Barrett's esophagus using systemic or local 5-aminolaevulinic acid. Gut 2001,48:314-319.
- Shimada S, Yagi Y, Shiomori K, et al.: Characterization of early gastric cancer and proposal of the optimal therapeutic strategy. Surgery 2001,129:714-719.
- Ponchon T: Endoscopic mucosal resection. J Clin Gastroenterol 2001,32:6-10.
- Inoue H: Treatment of esophageal and gastric tumors. Endoscopy 2001,33:119-125.
- Ponchon T: Endoscopic mucosal resection. J Clin Gastroenterol 2001,32:6-10.
- Folli S, Morgagni P, Roviello F, et al.: Risk factors for lymph node metastases and their prognostic significance in early gastric cancer (EGC) for the Italian research group for gastric cancer. Jpn J Clin Oncol 2001,31:495-499.
- Shimada S, Yagi Y, Shiomori K, et al.: Characterization of early gastric cancer and proposal of the optimal therapeutic strategy. Surgery 2001,129:714-719.
- Lambert R: Treatment of esophagogastric tumors. Endoscopy 2000,32:322-330.
- Ponchon T: Endoscopic mucosal resection. J Clin Gastroenterol 2001,32:6-10.
- Malhi-Chowla N, Wolfsen HC, DeVault KR: Esophageal dysmotility in patients undergoing photodynamic therapy. Mayo Clin Proc 2001,76:987-989.
- Fujita H, Sueyoshi S, Yamana H, et al.: Optimum treatment strategy for superficial esophageal cancer: endoscopic mucosal resection versus radical esophagectomy. World J Surg 2001,25:424-431.
- Takeo Y, Yoshida T, Shigemitu T, et al.: Endoscopic mucosal resection for early esophageal cancer and esophageal dysplasia. Hepatogastroenterology 2001,48:453-457.
- Buttar NS, Wang KK, Lutzke LS, et al.: Combined endoscopic mucosal resection and photodynamic therapy for esophageal neoplasia within Barrett's esophagus. Gastrointest Endosc 2001,54:682-688.
- Ono H, Kondo H, Gotoda T, et al.: Endoscopic mucosal resection for treatment of early gastric cancer. Gut 2001,48:225-229.
- Yoshikane H, Sakakibara A, Hidano H, et al.: Piecemeal endoscopic aspiration mucosectomy for large superficial intramucosal tumors of the stomach. Endoscopy 2001,33:795-799.
- Suzuki H, Ikeda K: Endoscopic mucosal resection and full thickness resection with complete defect closure for early gastrointestinal malignancies. Endoscopy 2001,33:437-439.
- Waxman I, Saitoh Y, Gottumukkala S, et al.: High-frequency probe EUS-assisted endoscopic mucosal resection: a therapeutic strategy for submucosal tumors of the GI tract. Gastrointest Endosc 2002,55:44-49.
- Wang KK, Sampliner RE: Mucosal ablation therapy of Barrett's esophagus. Mayo Clin Proc 2001,76:433-437.
- Radu A, Wagnieres G, van den Bergh H, et al.: Photodynamic therapy of early squamous cell cancers of the esophagus. Gastrointest Endosc Clin North Am 2000,10:439-460.
- Ackroyd R, Brown NJ, Davis MF, et al.: Photodynamic therapy for dysplastic Barrett's esophagus: a prospective, double blind, randomized, placebo controlled trial. Gut 2000,47:612-617.
- Overholt BF, Panjehpour M, Haydek JM: Photodynamic therapy for Barrett's esophagus: follow-up in 100 patients. Gastrointest Endosc 1999,49:1-7.
- Overholt BF, Haggitt RC, Bronner MP, et al.: A multicenter, partially blinded, randomised study of the efficacy of photodynamic therapy (PDT) using porfimer sodium (POR) for the ablation of high-grade dysplasia (HGD) in Barrett's esophagus (BE): results of 6-month follow-up (abstract). Gastroenterology 2001.
- Gossner L, Stolte M, Sroka R, et al.: Photodynamic ablation of high-grade dysplasia and early cancer in Barrett's esophagus by means of 5-aminolevulinic acid. Gastroenterology 1998,114:448-455.
- Maier A, Tomaselli F, Matzi V, et al.: Photosensitization with hematoporphyrin derivative compared with 5-aminolaevulinic acid for photodynamic therapy of esophageal carcinoma. Ann Thorac Surg 2001,72:1136-1140.
- Krishnadadath KK, Wang KK, Taniguchi K, et al.: Persistent genetic abnormalities in Barrett's esophagus after photodynamic therapy. Gastroenterology 2000,119:624-630.
- Van Laethem JL, Cremer M, Peny MO, et al.: Eradication of Barrett's mucosa with argon plasma coagulation and acid suppression: immediate and mid term results. Gut 1998,43:7447-7451.
- Byrne J, Armstrong G, Atwood S: Restoration of the normal squamous lining in Barrett's esophagus by argon beam plasma coagulation. Am J Gastroenterol 1998,93:1810-1815.
- Mork H, Barth T, Kreipe H, et al.: Reconstitution of squamous epithelium in Barrett's esophagus with endoscopic argon plasma coagulation: a prospective study. Scand J Gastroenterol 1998,33:1130-1134.
- Grade AJ, Shah IA, Medlin SM, et al.: The efficacy and safety of argon plasma coagulation therapy in Barrett's esophagus. Gastrointest Endosc 1999,50:18-22.
- Pereira-Lima JC, Busnello JV, Saul C, et al.: High power setting argon plasma coagulation for the eradication of Barrett's esophagus. Am J Gastroenterol 2000,95:1661-1668.
- Schulz H, Miehlke S, Antos D, et al.: Ablation of Barrett's epithelium by endoscopic argon plasma coagulation in combination with high-dose omeprazole. Gastrointest Endosc 2000,51:659-663.
- May A, Gossner L, Gunter E, et al.: Local treatment of early cancer in short Barrett's esophagus by means if argon plasma coagulation: initial experience. Endoscopy 1999,31:497-500.
- Van Laethem JL, Jagodzinski R, Peny MO, et al.: Argon plasma coagulation in the treatment of Barrett's high-grade dysplasia and in situ adenocarcinoma. Endoscopy 2001,33:257-261.
- Sampliner RE, Fennerty B, Garewal H: Reversal of Barrett's esophagus with acid suppression and multipolar electrocoagulation: preliminary results. Gastrointest Endosc 1996,44:523-525.
- Sharma P, Bhattacharyya A, Garewal H, et al.: Durability of new squamous epithelium after endoscopic reversal of Barrett's esophagus. Gastrointest Endosc 1999,50:159-164.
- Sampliner RE, Faigel D, Fennerty MB, et al.: Effective and safe endoscopic reversal of nondysplastic Barrett's esophagus with thermal electrocoagulation combined with high-dose acid inhibition: a multicenter study. Gastrointest Endosc 2001,53:554-558.
- Faigel DO, Lieberman DA, Weinstein WM, et al.: Effect of multipolar electrocoagulation on EUS findings in Barrett's esophagus. Gastrointest Endosc 2002,55:23-26.
- Sharma P, Jaffe PE, Bhattacharyya A, et al.: Laser and multipolar electrocoagulation ablation of early Barrett's adenocarcinoma: long-term follow-up. Gastrointest Endosc 1999,49:442-446.
- Barham CP, Jones RL, Biddlestone LR, et al.: Photothermal laser ablation of Barrett's esophagus: endoscopic and histologic evidence of squamous re-epithelialisation. Gut 1997,41:281-284.
- Biddlestone LR, Barham CP, Wilkinson SP, et al.: The histopathology of treated Barrett's esophagus: squamous reepithelialization after acid suppression and laser and photodynamic therapy. Am J Surg Pathol 1998,22:239-245.
- Gossner L, May A, Stolte M, et al.: KTP laser destruction of dysplasia and early cancer in columnar-lined Barrett's esophagus. Gastrointest Endosc 1999,49:8-12.
- Salo JA, Salminen JT, Kiviluoto TA, et al.: Advances in surgical technique. Ann Surg 1998,227:40-44.
- Pasricha PJ, Hill S, Wadwa KS, et al.: Endoscopic cryotherapy: experimental results and first clinical use. Gastrointest Endosc 1999,49:131-143.
- Johnson MH, Schoefeld P, Jagannatha V, et al.: Endoscopic spray cryotherapy: a new technique for mucosal ablation in the esophagus. Gastrointest Endosc 1999,50:86-92.
- Akahoshi K, Chijiwa Y, Hamada S, et al.: Pretreatment staging of endoscopically early gastric cancer with a 15 MHz ultrasound catheter probe. Gastrointest Endosc 1998,48:470-476.
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.














.jpg)





.png)



.jpg)

.jpg)













Комментарии