- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Дайджест
- QuaCol
- Разделы
- Пациентy
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: MAPS II Новые Европейские рекомендации по ведению пациентов с предраковыми изменениями в желудке
| Авторы: | В.В. ЦУКАНОВ, А.В. ВАСЮТИН, Ю.Л. ТОНКИХ, О.В. ПЕРЕТЯТЬКО 1 2019г. |
| Об авторах: |
1. Федеральное ГБУ «Федеральный исследовательский центр «Красноярский научный центр» Сибирского отделения Российской академии наук» |
06 марта 2019 г. опубликованы Европейские рекомендации по предраковым заболеваниям и поражениям желудка MAPS II .
Данный документ обновляет первую версию MAPS I от 2012 года.
Аннотация:
Цель обзора: проанализировать современные аспекты тактики ведения пациентов с предраковыми изменениями в желудке, изложенные в новых европейских рекомендациях MAPS II.

Полный текст статьи:
ЗАБОЛЕВАНИЯ ПИЩЕВОДА И ЖЕЛУДКА
Новые европейские рекомендации
ПО ВЕДЕНИЮ ПАЦИЕНТОВ С ПРЕДРАКОВЫМИ ИЗМЕНЕНИЯМИ В ЖЕЛУДКЕ
В.В. ЦУКАНОВ, А.В. ВАСЮТИН, Ю.Л. ТОНКИХ, О.В. ПЕРЕТЯТЬКО
Федеральное государственное бюджетное научное учреждение «Федеральный исследовательский центр «Красноярский научный центр» Сибирского отделения Российской академии наук», Обособленное подразделение «Научно-исследовательский институт медицинских проблем Севера» Министерства науки и высшего образования Российской Федерации: 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 3 «Г»
Цуканов Владислав Владимирович - д.м.н., профессор, заведующий клиническим отделением патологии пищеварительной системы Федерального государственного бюджетного научного учреждения «Федеральный исследовательский центр «Красноярский научный центр» Сибирского отделения Российской академии наук», Обособленное подразделение «Научно-исследовательский институт медицинских проблем Севера» Министерства науки и высшего образования Российской Федерации; тел.: +7 (391) 256-81-71; e-mail: gastro@impn.ru.
Васютин Александр Викторович - к.м.н., старший научный сотрудник клинического отделения патологии пищеварительной системы у взрослых и детей Федерального государственного бюджетного научного
учреждения «Федеральный исследовательский центр «Красноярский научный центр» Сибирского отделения Российской академии наук», Обособленное подразделение «Научно-исследовательский институт медицинских проблем Севера» Министерства науки и высшего образования Российской Федерации; тел.: +7 (391) 256-81-71; е-mail: alexander@kraslan.ru. Тонких Юлия Леонгардовна - к.м.н., ведущий научный сотрудник клинического отделения патологии пищеварительной системы у взрослых и детей Федерального государственного бюджетного научного учреждения «Федеральный исследовательский центр «Красноярский научный центр» Сибирского отделения Российской академии наук», Обособленное подразделение «Научно-исследовательский инсти-
тут медицинских проблем Севера» Министерства науки и высшего образования Российской Федерации; тел.: +7 (391) 256-81-71; е-mail: tjulia@bk.ru Перетятько Ольга Викторовна - к.м.н., научный сотрудник клинического отделения патологии пищеварительной системы у взрослых и детей Федерального государственного бюджетного научного учреждения «Федеральный исследовательский центр «Красноярский научный центр» Сибирского отделения Российской академии наук», Обособленное подразделение «Научно-исследовательский институт медицинских проблем Севера» Министерства науки и высшего образования Российской Федерации; тел.: +7 (391) 256-81-71; е-mail: peretyatkoolga@mail.ru
РЕЗЮМЕ
Цель обзора: проанализировать современные аспекты тактики ведения пациентов с предраковыми изменениями в желудке, изложенные в новых европейских рекомендациях MAPS II.
Основные положения. Для квалифицированной диагностики предраковых изменений в желудке необходимо применение современных эндоскопических и морфологических методов. Своевременное выявление атрофии, метаплазии и дисплазии значительно повышает эффективность предупреждения рака желудка. Эрадикация инфекции Helicobacter pylori является важным принципом ведения больных с предраковыми изменениями в желудке.
Заключение. В соответствии с европейскими рекомендациями, своевременная диагностика, адекватное лечение и последующее наблюдение пациентов с предраковыми изменениями желудка играют важную роль в профилактике рака желудка. Применение таких принципов в ежедневной клинической практике позволит стандартизировать подход к ведению пациентов с предопухолевой патологией.
Ключевые слова: атрофия, метаплазия, Дисплазия, Helicobacter pylori, Диагностика, профилактика, рак желуДка
Для цитирования: Цуканов В.В., Васютин А.В., Тонких Ю.Л., Перетятько О.В. Новые европейские рекомендации по ведению пациентов с предраковыми изменениями в желудке. . 2019; 3: 44-47. DOI: https://doi.org/10.21518/2079-701X-2019-3-44-47.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
FOR THE MANAGEMENT OF PATIENTS WITH PRECANCEROUS CHANGES IN THE STOMACH
Vladislav V. TSUKANOV, Alexander V. VASYUTIN, Julia L. TONKIH, Olga V. PERETYATKO
Research Institute for Medical Problems in the North - Division of Federal Research Center «Krasnoyarsk Scientific Center of the Siberian Branch of the RAS»: 660022, Russia, Krasnoyarsk, 3 «Г» Partizana Zheleznyaka Street
Tsukanov Vladislav Vladimirovich - Dr. of Sci. (Med), Professor, Head of the Clinical Department of Pathology of the Digestive System of the Research Institute for Medical Problems in the North - Division of Federal
Research Center «Krasnoyarsk Scientific Center of the Siberian Branch of the RAS; tel.: +7 (391) 256-81-71; е-mail: gastro@impn.ru. Vasyutin Alexander Viktorovich - Cand. of Sci. (Med.), Senior Researcher at the
Clinical Department of Pathology of the Digestive System in Adults and Children of the Research Institute for Medical Problems in the North - Division of Federal Research Center «Krasnoyarsk Scientific
44
Center of the Siberian Branch of the RAS;
tel.: +7 (391) 256-81-71; е-mail: alexander@kraslan.ru.
Tonkih Julia Leongardovna - Cand. of Sci.
(Med.), Leading Researcher of the Clinical Department of Pathology of the Digestive
System in Adults and Children of the Research Institute for Medical Problems in
the North - Division of Federal Research Center «Krasnoyarsk Scientific Center of the Siberian Branch of the RAS;
tel.: +7 (391) 256-81-71;
е-mail: tjulia@bk.ru
Peretyatko Olga Viktorovna - Cand. of Sci. (Med.), Researcher of the Clinical Department of Pathology of the Digestive
System in Adults and Children of the Research Institute for Medical Problems in the North - Division of Federal Research Center «Krasnoyarsk Scientific Center of the Siberian Branch of the RAS;
tel.: +7 (391) 256-81-71; е-mail: peretyatkoolga@mail.ru
ABSTRACT
Aim of the review: to analyze the current aspects of the management of patients with precancerous changes in the stomach, as outlined in the new MAPS II European recommendations.
Basic provisions. For qualified diagnosis of precancerous changes in the stomach it is necessary to use modern endoscopic and morphological methods. Timely detection of atrophy, metaplasia and dysplasia significantly increases the effectiveness of gastric cancer prevention. Eradication of Helicobacter pylori infection is an important principle in the management of patients with precancerous changes in the stomach.
Conclusion. According to European recommendations, timely diagnosis, adequate treatment and follow-up of patients with precancerous gastric changes play an important role in the prevention of stomach cancer. The application of such principles in daily clinical practice will allow standardization of the approach to the management of patients with pre-tumor pathology.
Keywords: atrophy, metaplasia, dysplasia, Helicobacter pylori, diagnostics, prophylaxis, stomach cancer
For citing: Tsukanov V.V., Vasyutin A.V., Tonkih Y.L., Peretyatko O.V. New European guidelines for the management of patients with precancerous changes in the stomach. Meditsinsky Sovet. 2019; 3: 44-47. DOI: https://doi.org/10.21518/2079-701X-2019-3-44-47.
Conflict of interest: The authors declare no conflict of interest.
DISEASES OF THE ESOPHAGUS AND STOMACH
Рак желудка в настоящее время находится на четвертом месте в структуре онкологической заболеваемости во всем мире и является одной из ведущих причин смертности от онкологической патологии [1]. Считается, что выявление пациентов с предраковыми изменениями желудка и наблюдение за ними способствует ранней диагностике аденокарциномы и более эффективному лечению [2, 3]. В последнее время эта проблема становится чрезвычайно актуальной в связи с информацией о тенденции к увеличению заболеваемости раком желудка в США [4].
В 2019 г. были опубликованы вторые рекомендации по ведению пациентов с предраковыми состояниями и изменениями желудка (Management of epithelial precancerous conditions and Lesions in the stomach - MAPS II) [5]. Следует отметить, что эти рекомендации были созданы тремя группами специалистов: Европейским обществом гастроинтестинальной эндоскопии (ESGE), Европейской группой по изучению Helicobacter и микробиоты (ESMHG) и Европейским обществом патологоанатомов (ESP), что особенно важно для комплексной диагностики патологии желудка.
Положение 1 MAPS II. Пациенты с хроническим атрофическим гастритом или кишечной метаплазией находятся в группе риска развития аденокарциномы желудка.
Это известное положение было подтверждено также 5-м Маастрихтским консенсусом в 2016 г. [6] и Киотским консенсусом по гастриту [7].
Положение 2 MAPS II. Гистологически подтвержденная кишечная метаплазия является наиболее надежным маркером атрофии слизистой оболочки желудка.
Хронический атрофический гастрит и кишечная метаплазия являются предраковыми изменениями, потому что
они создают независимый риск развития аденокарциномы желудка [8].
Положение 4 MAPS II. При ведении пациентов с хроническим атрофическим гастритом и кишечной метаплазией развитие дисплазии высокой степени и инвазивный рак желудка должны быть определены как исходы, которые необходимо предотвратить.
Считается, что хронический атрофический гастрит и кишечная метаплазия являются предраковыми состояниями, поскольку они независимо создают риск развития рака желудка и представляют собой фон, на котором могут возникать дисплазия и аденокарцинома. Кишечная метаплазия считается ключевым биомаркером предраковых поражений и часто рассматривается в качестве «точки невозврата», после которой изменения слизистой желудка становятся необратимыми. Дисплазия слизистой оболочки представляет собой предпоследнюю стадию канцерогенеза рака желудка и гистологически определяется как однозначно опухолевый эпителий без признаков тканевой инвазии и, таким образом, является прямым предраковым поражением [9]. Правильная диагностика и стадирование дисплазии имеют решающее значение, потому что предопределяют риск злокачественного перерождения.
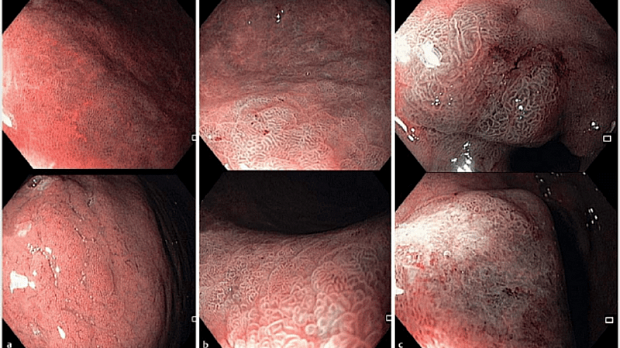
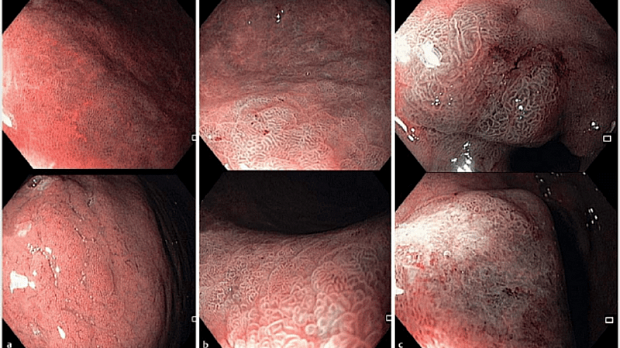
Положение 6 MAPS II. Эндоскопия высокой четкости с хромоэндоскопией лучше, чем только эндоскопия высокой четкости для диагностики предраковых состояний желудка и ранних опухолевых поражений.
В современном метаанализе, включающем 10 исследований, 699 пациентов и 902 поражения, объединенная чувствительность, специфичность и площадь под кривой хромоэндоскопии составляли 0,90 (95% доверительный интервал (ДИ) 0,87-0,92), 0,82 (95% ДИ 0,79-0,86) и 0,95
45
ЗАБОЛЕВАНИЯ ПИЩЕВОДА И ЖЕЛУДКА
соответственно. Эти результаты были значительно лучше, чем у обычной эндоскопии [10]. Тем не менее хромоэндоскопия с красителем является сложным методом и значительно удлиняет процедуру исследования.
Положение 10 MAPS II. Системы для гистологического определения стадии гастрита (например, OLGA и OLGIM) могут использоваться для идентификации пациентов с поздними стадиями атрофического гастрита.
В 2008 г. международной группой гастроэнтерологов и морфологов была предложена новая система стадиро- вания атрофического гастрита OLGA («Operative Link for Gastritis Assessment»). Эта система суммирует показатели атрофии в теле и антральном отделе желудка с определением баллов в каждом биоптате. III, IV стадии выраженности атрофического гастрита по системе OLGA свидетельствует о высокой вероятности развития рака желудка [11]. На основании классификации OLGA была разработана модификация OLGIM, основанная на оценке кишечной метаплазии [12].
Положение 11 MAPS II. Низкие уровни пепсиногена I в сыворотке и/или низкое соотношение пепсиногенов I/II выявляют пациентов с продвинутыми стадиями атрофического гастрита, и для этих пациентов рекомендуется эндоскопия, особенно если серологический тест на H. PYLORI ОТРИЦАТЕЛЬНЫЙ.
Как было указано в MAPS I [13], низкий уровень пепсиногена I в сыворотке, низкое соотношение пепсиногена I/II или оба являются хорошими показателями атрофических изменений слизистой оболочки желудка. Работы, опубликованные после MAPS I, подтверждают, что уровни пепсиногенов являются предикторами атрофического гастрита и риска развития рака желудка. Метаанализ 2015 года по тестам на пепсиноген при раке желудка и атрофическом гастрите позволил получить высокую корреляцию между снижением уровня пепсиногена в сыворотке и атрофией. Суммарная чувствительность и суммарная специфичность диагностики рака желудка составили 0,69 (95% ДИ 0,60-0,76) и 0,73 (95% ДИ 0,62-0,82) соответственно. Соответствующие значения для диагностики атрофического гастрита были 0,69 (95% ДИ 0,55-0,80) и 0,88 (95% ДИ 0,77-0,94) соответственно. График Фагана показал, что использование уровней пепсиногена в сыворотке крови может улучшить частоту выявления рака желудка и атрофического гастрита [14].
Положение 16 MAPS II. У пациентов с кишечной метаплазией в одиночной локализации, но с семейным анамнезом рака желудка или с неполной кишечной метаплазией можно рекомендовать эндоскопическое наблюдение с хромоэндоскопией и биопсией через 3 года.
Недавнее исследование с последующим 16-летним наблюдением показало, что кишечная метаплазия неполного типа была ассоциирована с более высоким риском развития рака желудка, чем полный тип метаплазии (относительный риск (ОР) = 11,3; 95% ДИ 1,4-91,4) [15]. Эти результаты и данные других исследований показыва
ют, что неполный тип кишечной метаплазии связан с риском прогрессирования заболевания, подобным тому, который приписывают обширной атрофии или семейной истории рака желудка. По этим причинам эта информация может иметь прогностическую ценность и важна для отбора пациентов для диспансерного наблюдения. Родственники первой степени молодых пациентов с раком желудка имеют более высокую частоту атрофического гастрита высокой стадии (стадия III/IV OLGA) и дисплазии, которые, по-видимому, связаны со штаммами H. pylori с высокой вирулентностью и провоспалительны- ми генотипами хозяина, что приводит к повышенному риску развития рака желудка [16].
Положение 17 MAPS II. Пациенты с продвинутыми стадиями атрофического гастрита (тяжелые атрофические изменения или кишечная метаплазия как в антральном отделе, так и в теле желудка, OLGA/OLGIM III/IV) должны проходить высококачественную эндоскопию каждые 3 года.
В целом существует значительно более высокий риск прогрессирования рака у пациентов с дисплазией, кишечной метаплазией и/или атрофией стадии III/IV (OLGA/ OLGIM). Поэтому авторы MAPS II рекомендуют эндоскопическое наблюдение за этими пациентами, в идеале с помощью высококачественной эндоскопии. Тем не менее риск рака желудка также увеличивается и у пациентов с менее выраженными стадиями преднеопластических изменений. Основываясь на экспертном мнении, авторы рекомендуют, что пациенты с кишечной метаплазией должны быть повторно осмотрены через 3 года [5].
Положение 20 MAPS II. Эрадикация H. pylori лечит хронический неатрофический гастрит, может привести к регрессии атрофического гастрита и снижает риск рака желудка у пациентов с неатрофическим и атрофическим гастритом и, следовательно, рекомендуется для пациентов с этими состояниями.
Положение 21 MAPS II. У пациентов с кишечной метаплазией ЭРАДИКАЦИЯ H. PYLORI, ПО-ВИДИМОМУ, НЕ ДАЕТ обратного развития метаплазии, но уменьшает воспаление и атрофию. В этой связи ЭРАДИКАЦИЯ H. PYLORI У таких больных рекомендуется.
Два метаанализа, которые фокусировались на риске рака желудка после эрадикации H. pylori, показали, что эрадикация H. pylori значительно снижает риск рака желудка у пациентов с хроническим атрофическим или неатрофическим гастритом (ОР=0,64; 95% ДИ 0,48-0,85), но не у пациентов с кишечной метаплазией или дисплазией (ОР=0,88, 95% ДИ 0,59-1,31) [17, 18]. Тем не менее у пациентов с кишечной метаплазией эрадикация H. pylori оказывает благотворное гистологическое действие. В этой связи авторы MAPS II считают, что эрадикацию H. pylori также следует проводить и у пациентов с кишечной метаплазией [5]. Важно отметить, что инфекция H. pylori вызывает и другие заболевания желудка и ДПК, поэтому эрадикация рекомендована в большинстве случаев, помимо наличия предраковых состояний [6, 19].
Положение 22 MAPS II. Эрадикация H. pylori рекомендуется для пациентов с неоплазией желудка после эндоскопической терапии.
Двойное слепое плацебо-контролируемое клиническое исследование 2018 года, в котором участвовало 396 пациентов, убедительно показало, что эрадикация H. pylori снижает риск метахронного рака желудка почти до половины (7% против 13%; ОШ=0,5, 95% ДИ 0,26-0,94) [20].
Положение 25 MAPS II. В регионах среднего и высокого риска рака желудка выявление и наблюдение пациентов с предраковыми состояниями желудка является экономически эффективным.
В заключение следует сказать несколько слов об эра- дикации H. pylori. Маастрихт 5 [6] и ежегодное итоговое совещание EHMSG, состоявшееся в сентябре 2018 г. в г. Каунас (Литва), пришли к выводу, что преобладающим методом эрадикации H. pylori в настоящее время является четырехкомпонентная терапия [21]. Аналогичный взгляд отстаивают авторы российской части большого европей
ского наблюдательного исследования, посвященного определению эффективности эрадикации H. pylori [22]. Эта точка зрения в целом поддерживается рекомендациями Российской гастроэнтерологической ассоциации [23]. Оптимальным методом четырехкомпонентной терапии в России является схема: препарат висмута + ингибитор протонной помпы + кларитромицин + амоксициллин, назначаемая на 10-14 дней. Для повышения эффективности терапии первой линии целесообразно преимущественно применять эзомепразол или рабепразол [24].
Таким образом, в соответствии с европейскими рекомендациями MAPS II, своевременная диагностика, адекватное лечение и последующее наблюдение пациентов с предраковыми изменениями желудка играют важную роль во вторичной профилактике рака желудка. Применение таких принципов в ежедневной клинической практике позволит стандартизировать подход к ведению пациентов с предопу- холевой патологией в России. Одним из оптимальных методов профилактики и лечения предраковых изменений в желудке является эрадикация H. pylori [25, 26]..
Рекомендация 1 (MAPS II). Пациенты с хроническим атрофическим гастритом или кишечной метаплазией подвержены риску развития аденокарциномы желудка (высокий уровень доказательности). Хронический атрофический гастрит и кишечную метаплазию (КМ) рассматривают как предраковые состояния, поскольку они сами по себе связаны с риском развития рака желудка и на их фоне возможно развитие дисплазии и аденокарциномы.
Рекомендация 2 (MAPS II). Гистологически подтвержденная кишечная метаплазия — наиболее надежный маркер атрофии слизистой оболочки желудка (высокий уровень доказательности).
Рекомендация 3 (MAPS II). Необходимо выявлять пациентов с гастритом на поздних стадиях, т. е. с атрофией и (или) кишечной метаплазией, слизистой оболочки как антрального отдела желудка, так и тела желудка, поскольку считается, что они подвержены более высокому риску развития аденокарциномы желудка (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 4 (MAPS II). Дисплазию тяжелой степени и инвазивную карциному следует рассматривать как исходы, которые необходимо предотвратить при лечении пациентов с хроническим атрофическим гастритом или кишечной метаплазией (умеренный уровень доказательности, сильная рекомендация). Интраэпителиальная неоплазия / дисплазия включает однозначно эпителиальные и опухолевые пролиферации, характеризующиеся вариабельной клеточной и архитектурной атипией, но без убедительных доказательств инвазии. Интраэпителиальная неоплазия / дисплазия низкой степени выраженности вызывает минимальный архитектурный беспорядок и цитологическую атипию от легкой до умеренной степени. Интраэпителиальная неоплазия / дисплазия высокой степени включает опухолевые клетки, которые обычно являются кубоидальными, а не столбчатыми, с высоким отношением ядра к цитоплазме, выраженными амфофильными ядрышками, более выраженным архитектурным беспорядком и многочисленными митозами, которые могут быть нетипичными. Важно отметить, что ядра часто простираются в просветную сторону клетки, и полярность ядра обычно теряется. Большинство пациентов с поражениями, классифицированными как дисплазия высокой степени тяжести (HGD), подвержены высокому риску либо синхронной инвазивной карциномы, либо ее быстрого развития. Интравазозная инвазивная неоплазия / внутрислизистая карцинома определяет карциномы, которые проникают в собственную пластинку слизистой оболочки и отличаются от интраэпителиальной неоплазии / дисплазии не только десмопластическими изменениями, которые могут быть минимальными или отсутствующими, но также и различными структурными аномалиями, такими как выраженное скопление желез, скученность, чрезмерное ветвление и слитые или ситообразные железы. Диагноз карциномы слизистой оболочки означает, что существует повышенный риск лимфатической инвазии и метастазирования лимфатических узлов, хотя при определенных особенностях этот риск отсутствует или минимален. Предраковые и ранние поражения желудка
Рекомендация 5 (MAPS II). У пациентов с эндоскопически определяемыми патологическими изменениями, указывающими на дисплазию легкой или тяжелой степени или карциному, следует определить стадию заболевания и начать лечение (высокий уровень доказательности, сильная рекомендация). 4 Диагностика и постановка Эндоскопия
Рекомендация 6 (MAPS II). Эндоскопия высокого разрешения в сочетании с хромоэндоскопией более эффективна, чем эндоскопия высокого разрешения в белом свете, при диагностике предраковых состояний желудка и неопластических поражений на ранней стадии (высокий уровень доказательности).
Рекомендация 7 (MAPS II). При наличии возможности и после надлежащего обучения для диагностики предраковых состояний желудка следует применять виртуальную хромоэндоскопию с увеличением или без увеличения изображения, что позволяет выполнять контролируемую биопсию на участках атрофических и метапластических изменений, а также обеспечивает выявление неопластических поражений (умеренный уровень доказательности, сильная рекомендация). Взятие биопсии
Рекомендация 8 (MAPS II). Для надлежащего определения стадии предраковых состояний желудка первая диагностическая эндоскопия верхнего отдела желудочно-кишечного тракта должна включать взятие биопсийных образцов из желудка для определения наличия инфекции Helicobacter pylori и выявления атрофического гастрита на поздних стадиях (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 9 (MAPS II). Следует выполнить биопсию как минимум на двух топографических участках (по малой и большой кривизне, как в антральном отделе желудка, так и в теле желудка). Следует дополнительно выполнить биопсию видимых предполагаемых неопластических поражений (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 10 (MAPS II). Для выявления пациентов с гастритом на поздних стадиях можно использовать системы гистопатологического определения стадии заболевания (например, оперативную систему оценки гастрита (OLGA) и оперативную систему оценки гастрита, основанную на кишечной метаплазии (OLGIM)). Стадии III и IV могут указывать на пациентов, подверженных более высокому риску развития рака желудка. Следует рассмотреть возможность выполнения дополнительной биопсии из угла желудка (умеренный уровень доказательности, слабая рекомендация). Данный подход позволяет обеспечить максимальную степень выявления пациентов с предраковыми состояниями, в особенности в случаях, когда применение хромоэндоскопии для прицельной биопсии невозможно . Неинвазивная оценка
Рекомендация 11 (MAPS II). Низкие уровни пепсиногена I в сыворотке и/или низкое соотношение пенсиногенов I/II выявляют пациентов с продвинутыми стадиями атрофического гастрита, и для этих пациентов рекомендуется эндоскопия, особенно если серологический тес на Н.pylori был отрицательный. Дополнительные факторы риска
Рекомендация 12 (MAPS II). Несмотря на то, что в различных исследованиях оценивались возраст, пол и факторы вирулентности H. pylori , а также генетические вариации хозяина, для целенаправленного ведения на основе этих факторов не может быть сделано никаких клинических рекомендаций относительно диагностики и наблюдения (низкий уровень доказательности, слабая рекомендация) Наблюдение Дисплазия
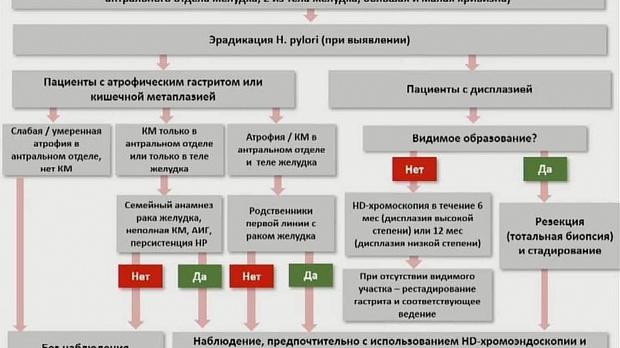
Рекомендация 13 (MAPS II). У пациентов с дисплазией при отсутствии эндоскопически определенного очага рекомендуется немедленная высококачественная эндоскопическая переоценка с помощью хромоэндоскопии (виртуальной или на основе красителя). Если в этой высококачественной эндоскопии поражение не обнаружено, рекомендуется биопсия для постановки гастрита (если не было сделано ранее) и эндоскопического наблюдения в течение от 6 месяцев (при дисплазии высокой степени) до 12 месяцев (при дисплазии низкой степени). (низкий уровень доказательности, сильная рекомендация) Атрофический гастрит / кишечная метаплазия
Рекомендация 14 (MAPS II). Для пациентов с атрофией легкой и средней степени тяжести, ограниченной антральным отделом, нет никаких оснований рекомендовать наблюдение. (умеренный уровень доказательности, сильная рекомендация)
Рекомендация 15 (MAPS II). Пациенты с IM в одном месте имеют более высокий риск рака желудка. Однако этот повышенный риск не оправдывает наблюдения в большинстве случаев, особенно если высококачественная эндоскопия с биопсией исключает поздние стадии атрофического гастрита. (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 16 (MAPS II). У пациентов с кишечный метаплазией в одном месте, но с семейным анамнезом рака желудка, или с неполным IM, или с персистирующим гастритом H. pylori , можно рассмотреть эндоскопическое наблюдение с хромоэндоскопией и биопсией под контролем через 3 года. (низкий уровень доказательности, слабая рекомендация). Рекомендация 17 (MAPS II). Пациентам с поздними стадиями атрофического гастрита (тяжелые атрофические изменения или киш. метаплазия в антральном отделе и корпусе, OLGA / OLGIM III / IV) следует проводить высококачественную эндоскопию каждые 3 года. (низкий уровень доказательности, сильная рекомендация).
Рекомендация 18 (MAPS II). Пациенты с поздними стадиями атрофического гастрита и семейным анамнезом рака желудка могут выиграть от более интенсивного наблюдения (например, каждые 1-2 года после постановки диагноза). (низкий уровень доказательности, слабая рекомендация). Аутоиммунный гастрит Рекомендация 19 (MAPS II). Пациентам с аутоиммунным гастритом может быть полезно эндоскопическое наблюдение каждые 3 — 5 лет. (низкий уровень доказательности, слабая рекомендация). Терапия Ликвидация Helicobacter pylori
Рекомендация 20 (MAPS II). Эрадикация H. pylori лечит неатрофический хронический гастрит, может привести к регрессии атрофического гастрита и снижает риск рака желудка у пациентов с неатрофическим и атрофическим гастритом, и, следовательно, рекомендуется для пациентов с этими состояниями. (высокий уровень доказательности, сильная рекомендация).
Рекомендация 21 (MAPS II). У пациентов с установленной кишечной метаплазией эрадикация H. pylori , по-видимому, не значительно снижает риск рака желудка, по крайней мере, в краткосрочной перспективе, но уменьшает воспаление и атрофию, и, следовательно, это следует учитывать. (низкий уровень доказательности, слабая рекомендация). Рекомендация 22 (MAPS II). Эрадикация H. pylori рекомендуется для пациентов с желудочной неоплазией после эндоскопической терапии. (высокий уровень доказательности, сильная рекомендация). Другие методы лечения
Рекомендация 23 (MAPS II). Хотя ингибиторы циклооксигеназы (ЦОГ) -1 или ЦОГ-2 могут замедлять развитие предраковых состояний желудка, их нельзя рекомендовать специально для этой цели. (низкий уровень доказательности, слабая рекомендация). Рекомендация 24 (MAPS II). Низкие дозы аспирина в день могут рассматриваться для профилактики различных видов рака, включая рак желудка, у отдельных пациентов. (умеренный уровень доказательности, слабая рекомендация). Экономическая эффективность наблюдения и скрининга
Рекомендация 25 (MAPS II). В регионах от среднего до высокого риска выявление и наблюдение пациентов с предраковыми состояниями желудка является экономически эффективным. (умеренный уровень доказательности).
Стандартная ЭГДС с биопсией OLGA / OLGA-IM. Видео Vladyslav Yakovenko MD, PhD пациентка 31г жалобы на изжогу.Обнаружены хронический тонзилит, язык кишечной метаплазии ПЖП и эритематозная гастропатия.
Вывод:
Заключение. В соответствии с европейскими рекомендациями, своевременная диагностика, адекватное лечение и последующее наблюдение пациентов с предраковыми изменениями желудка играют важную роль в профилактике рака желудка. Применение таких принципов в ежедневной клинической практике позволит стандартизировать подход к ведению пациентов с предопухолевой патологией.
Список литературы:
Vaz Coelho L.G., Kim N. et al. Chronicles of a
cancer foretold: 35 years of gastric cancer risk
assessment. Gut. 2016;65(5):721-725.
2. Liu H., Li P.W., Yang W.Q., Mi H., Pan J.L., Huang Y.C.
et al. Identification of non-invasive biomarkers
for chronic atrophic gastritis from serum exoso-
mal microRNAs. BMC Cancer. 2019;19(1):129.
3. Цуканов В.В., Амельчугова О.С., Каспаров Э.В.,
Буторин Н.Н., Васютин А.В., Тонких Ю.Л.,
Третьякова О.В. Роль эрадикации Helicobacter
pylori в профилактике рака желудка. Терапевт.
арх. 2014;86(8):124-127. [Tsukanov V.V.,
Amelchugova O.S., Kasparov E.V., Butorin N.N.,
Vasyutin A.V., Tonkikh Y.L., Tretyakova O.V. The
role of Helicobacter pylori eradication in the
prevention of stomach cancer. Therapist Arch.
[Terapevt. arh.]. 2014;86(8):124-127.] (In Russ.)
4. Wang Z., Graham D.Y., Khan A., Balakrishnan M.,
Abrams H.R., El-Serag H.B., Thrift A.P. Incidence
of gastric cancer in the USA during 1999 to
2013: a 50-state analysis. Int J Epidemiol. 2018ю
[Epub ahead of print]. doi: 10.1093/ije/dyy055.
5. Pimentel-Nunes Pю, Libânio Dю, Marcos-Pinto
Rю, Areia Mю, Leja Mю, Esposito Gю et al.
Management of epithelial precancerous condi-
tions and lesions in the stomach (MAPS II):
European Society of Gastrointestinal Endoscopy
(ESGE), European Helicobacter and Microbiota
Study Group (EHMSG), European Society of
Pathology (ESP), and Sociedade Portuguesa de
Endoscopia Digestiva (SPED) guideline update
2019. Endoscopyю 2019;51(4):365-388.
6. Malfertheiner P., Megraud F., O’Morain C.A.,
Gisbert J.P., Kuipers E.J., Axon A.T. et al.
Management of Helicobacter pylori infection-
the Maastricht V/Florence Consensus Report.
Gut. 2017;66(1):6-30.
7. Sugano K., Tack J., Kuipers E.J., Graham DY,
El-Omar EM, Miura S et al. Kyoto global con-
sensus report on Helicobacter pylori gastritis.
Gut. 2015;64(9):1353-1367.
8. Kapadia C.R. Gastric atrophy, metaplasia and
dysplasia: a clinical perspective. J Clin
Gastroenterol. 2003;36(5 Suppl):S29-S36.
9. Correa P. Gastric cancer: overview. Gastroenterol
Clin North Am. 2013;42(2):211-217.
10. Zhao Z., Yin Z., Wang S., Wang J., Bai B., Qiu Z.,
Zhao Q. Meta-analysis: The diagnostic efficacy
of chromoendoscopy for early gastric cancer
and premalignant gastric lesions. J
Gastroenterol Hepatol, 2016;31(9):1539-1545.
11. Rugge M., Correa P., Di Mario F., El-Omar E.,
Fiocca R., Geboes K. et al. OLGA staging for gastri-
tis: a tutorial. Dig Liver Dis, 2008, 40(8): 650-658.
12. Capelle L.G., de Vries A.C., Haringsma J., Ter Borg F.,
de Vries R.A., Bruno M.J. et al. The staging of gastri-
tis with the OLGA system by using intestinal meta-
plasia as an accurate alternative for atrophic gas-
tritis. Gastrointest Endosc. 2010;71(7):1150-1158.
13. Dinis-Ribeiro M., Areia M., de Vries A.C., Marcos-
Pinto R., Monteiro-Soares M., O’Connor A. et al.
Management of precancerous conditions and
lesions in the stomach (MAPS): guideline from
the European Society of Gastrointestinal Endo-
scopy (ESGE), European Helicobacter Study Group
(EHSG), European Society of Pathology (ESP), and
the Sociedade Portuguesa de Endoscopia
Digestiva (SPED). Endoscopy. 2012;44(1):74-94.
14. Huang Y.K., Yu J.C., Kang W.M., Ma Z.Q., Ye X.,
Tian S.B., Yan C. Significance of Serum
Pepsinogens as a Biomarker for Gastric Cancer
and Atrophic Gastritis Screening: A Systematic
Review and Meta-Analysis. PLoS One.
2015;10(11):e0142080.
15. Mera R.M., Bravo L.E., Camargo M.C., Bravo J.C.,
Delgado A.G., Romero-Gallo J. et al. Dynamics
of Helicobacter pylori infection as a determi-
nant of progression of gastric precancerous
lesions: 16-year follow-up of an eradication
trial. Gut. 2018;67(7):1239-1246.
16. Marcos-Pinto R., Dinis-Ribeiro M., Carneiro F.,
Wen X., Lopes C., Figueiredo C. et al. First-
degree relatives of early-onset gastric cancer
patients show a high risk for gastric cancer:
phenotype and genotype profile. Virchows
Arch.2013;463(3):391-399.
17. Chen H.N., Wang Z., Li X., Zhou Z.G. Helicobacter
pylori eradication cannot reduce the risk of gas-
tric cancer in patients with intestinal metaplasia
and dysplasia: evidence from a meta-analysis.
Gastric Cancer. 2016;19(1):166-175.
18. Rokkas T., Rokka A., Portincasa P. A systematic
review and meta-analysis of the role of
Helicobacter pylori eradication in preventing
gastric cancer. Ann Gastroenterol.
2017;30(4):414-423.
19. Tsukanov V.V., Kasparov E.V., Tonkikh J.L.,
Shtygasheva O.V., Butorin N.N., Amelchugova
O.S. et al. Peptic Ulcer Disease and Helicobacter
pylori Infection in Different Siberian Ethnicities.
Helicobacter. 2017;22(1):e12322.
20. Choi I.J., Kook M.C., Kim Y.I., Cho S.J., Lee J.Y., Kim
C.G., Park B., Nam B.H. Helicobacter pylori Therapy
for the Prevention of Metachronous Gastric
Cancer. N Engl J Med. 2018;378(12):1085-1095.
21. O’Morain N.R., Dore M.P., O’Connor A.J.P., Gisbert
J.P., O’Morain C.A. Treatment of Helicobacter
pylori infection in 2018. Helicobacter.
2018;23(Suppl 1):e12519.
22. Бордин Д.С., Эмбутниекс Ю.В., Вологжанина
Л.Г., Ильчишина Т.А., Войнован И.Н.,
Сарсенбаева А.С. и др. Европейский регистр
Helicobacter pylori (Hp-EuReg): как измени-
лась клиническая практика в России с 2013
по 2018 г. Терапевт. арх. 2019;91(2):8–24.
[Bordin D.S., Embutnieks Yu.V., Vologzhanina
L.G., Ilchishina T.A., Voynovan I.N., Sarsenbaeva
A.S., etc. European register of Helicobacter
pylori (Hp-EuReg): how clinical practice in
Russia changed from 2013 to 2018. Therapeut.
Arch. [Terapevt. arh.]. 2019;91(2):8-24.] (In Russ.)
23. Ивашкин В.Т., Маев И.В., Лапина Т.Л., Шептулин
А.А., Трухманов А.С., Баранская Е.К. и др. Кли-
ни ческие рекомендации Российской гастроэн-
терологической ассоциации по диагностике и
лечению инфекции Helicobacter pylori у взрос-
лых. Рос. журн. гастроэнтерологии, гепатоло-
гии, колопроктологии. 2018;1:55-70. [Ivashkin
V.T., Maev I.V., Lapina T.L., Sheptulin A.A.,
Trukhmanov A.S., Baranskaya E.K. et al. Clinical
recommendations of the Russian Gastroentero-
logical Association on diagnosis and treatment
of Helicobacter pylori infection in adults. Ros.
journ. of gastroenterology, hepatology, coloproctol-
ogy [Ros. zhurn. gastrojenterologii, gepatologii,
koloproktologii]. 2018;1:55-70.] (In Russ.)
24. McNicholl A.G., Linares P.M., Nyssen O.P., Calvet
X., Gisbert J.P. Meta-analysis: esomeprazole or
rabeprazole vs. first-generation pump inhibitors
in the treatment of Helicobacter pylori infection.
Aliment Pharmacol Ther. 2012;36(5):414-425.
25. Graham D.Y. Helicobacter pylori update: gastric
cancer, reliable therapy, and possible benefits.
Gastroenterology. 2015;148(4):719-731.
26. McMahon B.J., Bruce M.G., Koch A., Goodman K.J.,
Tsukanov V., Mulvad G. et al. The diagnosis and
treatment of Helicobacter pylori infection in Arctic
regions with a high prevalence of infection: Expert
Commentary. Epidemiol Infect. 2016;144(2):225-33.1. Rugge M., Genta R.M., Graham D.Y., Di Mario F.,
Vaz Coelho L.G., Kim N. et al. Chronicles of a
cancer foretold: 35 years of gastric cancer risk
assessment. Gut. 2016;65(5):721-725.
2. Liu H., Li P.W., Yang W.Q., Mi H., Pan J.L., Huang Y.C.
et al. Identification of non-invasive biomarkers
for chronic atrophic gastritis from serum exoso-
mal microRNAs. BMC Cancer. 2019;19(1):129.
3. Цуканов В.В., Амельчугова О.С., Каспаров Э.В.,
Буторин Н.Н., Васютин А.В., Тонких Ю.Л.,
Третьякова О.В. Роль эрадикации Helicobacter
pylori в профилактике рака желудка. Терапевт.
арх. 2014;86(8):124-127. [Tsukanov V.V.,
Amelchugova O.S., Kasparov E.V., Butorin N.N.,
Vasyutin A.V., Tonkikh Y.L., Tretyakova O.V. The
role of Helicobacter pylori eradication in the
prevention of stomach cancer. Therapist Arch.
[Terapevt. arh.]. 2014;86(8):124-127.] (In Russ.)
4. Wang Z., Graham D.Y., Khan A., Balakrishnan M.,
Abrams H.R., El-Serag H.B., Thrift A.P. Incidence
of gastric cancer in the USA during 1999 to
2013: a 50-state analysis. Int J Epidemiol. 2018ю
[Epub ahead of print]. doi: 10.1093/ije/dyy055.
5. Pimentel-Nunes Pю, Libânio Dю, Marcos-Pinto
Rю, Areia Mю, Leja Mю, Esposito Gю et al.
Management of epithelial precancerous condi-
tions and lesions in the stomach (MAPS II):
European Society of Gastrointestinal Endoscopy
(ESGE), European Helicobacter and Microbiota
Study Group (EHMSG), European Society of
Pathology (ESP), and Sociedade Portuguesa de
Endoscopia Digestiva (SPED) guideline update
2019. Endoscopyю 2019;51(4):365-388.
6. Malfertheiner P., Megraud F., O’Morain C.A.,
Gisbert J.P., Kuipers E.J., Axon A.T. et al.
Management of Helicobacter pylori infection-
the Maastricht V/Florence Consensus Report.
Gut. 2017;66(1):6-30.
7. Sugano K., Tack J., Kuipers E.J., Graham DY,
El-Omar EM, Miura S et al. Kyoto global con-
sensus report on Helicobacter pylori gastritis.
Gut. 2015;64(9):1353-1367.
8. Kapadia C.R. Gastric atrophy, metaplasia and
dysplasia: a clinical perspective. J Clin
Gastroenterol. 2003;36(5 Suppl):S29-S36.
9. Correa P. Gastric cancer: overview. Gastroenterol
Clin North Am. 2013;42(2):211-217.
10. Zhao Z., Yin Z., Wang S., Wang J., Bai B., Qiu Z.,
Zhao Q. Meta-analysis: The diagnostic efficacy
of chromoendoscopy for early gastric cancer
and premalignant gastric lesions. J
Gastroenterol Hepatol, 2016;31(9):1539-1545.
11. Rugge M., Correa P., Di Mario F., El-Omar E.,
Fiocca R., Geboes K. et al. OLGA staging for gastri-
tis: a tutorial. Dig Liver Dis, 2008, 40(8): 650-658.
12. Capelle L.G., de Vries A.C., Haringsma J., Ter Borg F.,
de Vries R.A., Bruno M.J. et al. The staging of gastri-
tis with the OLGA system by using intestinal meta-
plasia as an accurate alternative for atrophic gas-
tritis. Gastrointest Endosc. 2010;71(7):1150-1158.
13. Dinis-Ribeiro M., Areia M., de Vries A.C., Marcos-
Pinto R., Monteiro-Soares M., O’Connor A. et al.
Management of precancerous conditions and
lesions in the stomach (MAPS): guideline from
the European Society of Gastrointestinal Endo-
scopy (ESGE), European Helicobacter Study Group
(EHSG), European Society of Pathology (ESP), and
the Sociedade Portuguesa de Endoscopia
Digestiva (SPED). Endoscopy. 2012;44(1):74-94.
14. Huang Y.K., Yu J.C., Kang W.M., Ma Z.Q., Ye X.,
Tian S.B., Yan C. Significance of Serum
Pepsinogens as a Biomarker for Gastric Cancer
and Atrophic Gastritis Screening: A Systematic
Review and Meta-Analysis. PLoS One.
2015;10(11):e0142080.
15. Mera R.M., Bravo L.E., Camargo M.C., Bravo J.C.,
Delgado A.G., Romero-Gallo J. et al. Dynamics
of Helicobacter pylori infection as a determi-
nant of progression of gastric precancerous
lesions: 16-year follow-up of an eradication
trial. Gut. 2018;67(7):1239-1246.
16. Marcos-Pinto R., Dinis-Ribeiro M., Carneiro F.,
Wen X., Lopes C., Figueiredo C. et al. First-
degree relatives of early-onset gastric cancer
patients show a high risk for gastric cancer:
phenotype and genotype profile. Virchows
Arch.2013;463(3):391-399.
17. Chen H.N., Wang Z., Li X., Zhou Z.G. Helicobacter
pylori eradication cannot reduce the risk of gas-
tric cancer in patients with intestinal metaplasia
and dysplasia: evidence from a meta-analysis.
Gastric Cancer. 2016;19(1):166-175.
18. Rokkas T., Rokka A., Portincasa P. A systematic
review and meta-analysis of the role of
Helicobacter pylori eradication in preventing
gastric cancer. Ann Gastroenterol.
2017;30(4):414-423.
19. Tsukanov V.V., Kasparov E.V., Tonkikh J.L.,
Shtygasheva O.V., Butorin N.N., Amelchugova
O.S. et al. Peptic Ulcer Disease and Helicobacter
pylori Infection in Different Siberian Ethnicities.
Helicobacter. 2017;22(1):e12322.
20. Choi I.J., Kook M.C., Kim Y.I., Cho S.J., Lee J.Y., Kim
C.G., Park B., Nam B.H. Helicobacter pylori Therapy
for the Prevention of Metachronous Gastric
Cancer. N Engl J Med. 2018;378(12):1085-1095.
21. O’Morain N.R., Dore M.P., O’Connor A.J.P., Gisbert
J.P., O’Morain C.A. Treatment of Helicobacter
pylori infection in 2018. Helicobacter.
2018;23(Suppl 1):e12519.
22. Бордин Д.С., Эмбутниекс Ю.В., Вологжанина
Л.Г., Ильчишина Т.А., Войнован И.Н.,
Сарсенбаева А.С. и др. Европейский регистр
Helicobacter pylori (Hp-EuReg): как измени-
лась клиническая практика в России с 2013
по 2018 г. Терапевт. арх. 2019;91(2):8–24.
[Bordin D.S., Embutnieks Yu.V., Vologzhanina
L.G., Ilchishina T.A., Voynovan I.N., Sarsenbaeva
A.S., etc. European register of Helicobacter
pylori (Hp-EuReg): how clinical practice in
Russia changed from 2013 to 2018. Therapeut.
Arch. [Terapevt. arh.]. 2019;91(2):8-24.] (In Russ.)
23. Ивашкин В.Т., Маев И.В., Лапина Т.Л., Шептулин
А.А., Трухманов А.С., Баранская Е.К. и др. Кли-
ни ческие рекомендации Российской гастроэн-
терологической ассоциации по диагностике и
лечению инфекции Helicobacter pylori у взрос-
лых. Рос. журн. гастроэнтерологии, гепатоло-
гии, колопроктологии. 2018;1:55-70. [Ivashkin
V.T., Maev I.V., Lapina T.L., Sheptulin A.A.,
Trukhmanov A.S., Baranskaya E.K. et al. Clinical
recommendations of the Russian Gastroentero-
logical Association on diagnosis and treatment
of Helicobacter pylori infection in adults. Ros.
journ. of gastroenterology, hepatology, coloproctol-
ogy [Ros. zhurn. gastrojenterologii, gepatologii,
koloproktologii]. 2018;1:55-70.] (In Russ.)
24. McNicholl A.G., Linares P.M., Nyssen O.P., Calvet
X., Gisbert J.P. Meta-analysis: esomeprazole or
rabeprazole vs. first-generation pump inhibitors
in the treatment of Helicobacter pylori infection.
Aliment Pharmacol Ther. 2012;36(5):414-425.
25. Graham D.Y. Helicobacter pylori update: gastric
cancer, reliable therapy, and possible benefits.
Gastroenterology. 2015;148(4):719-731.
26. McMahon B.J., Bruce M.G., Koch A., Goodman K.J.,
Tsukanov V., Mulvad G. et al. The diagnosis and
treatment of Helicobacter pylori infection in Arctic
regions with a high prevalence of infection: Expert
Commentary. Epidemiol Infect. 2016;144(2):225-33.
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.















.jpg)





.png)




















Комментарии 1
Рекомендация 1 (MAPS II). Пациенты с хроническим атрофическим гастритом или кишечной метаплазией подвержены риску развития аденокарциномы желудка (высокий уровень доказательности). Хронический атрофический гастрит и кишечную метаплазию (КМ) рассматривают как предраковые состояния, поскольку они сами по себе связаны с риском развития рака желудка и на их фоне возможно развитие дисплазии и аденокарциномы.
Рекомендация 2 (MAPS II). Гистологически подтвержденная кишечная метаплазия — наиболее надежный маркер атрофии слизистой оболочки желудка (высокий уровень доказательности).
Рекомендация 3 (MAPS II). Необходимо выявлять пациентов с гастритом на поздних стадиях, т. е. с атрофией и (или) кишечной метаплазией, слизистой оболочки как антрального отдела желудка, так и тела желудка, поскольку считается, что они подвержены более высокому риску развития аденокарциномы желудка (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 4 (MAPS II). Дисплазию тяжелой степени и инвазивную карциному следует рассматривать как исходы, которые необходимо предотвратить при лечении пациентов с хроническим атрофическим гастритом или кишечной метаплазией (умеренный уровень доказательности, сильная рекомендация). Интраэпителиальная неоплазия / дисплазия включает однозначно эпителиальные и опухолевые пролиферации, характеризующиеся вариабельной клеточной и архитектурной атипией, но без убедительных доказательств инвазии. Интраэпителиальная неоплазия / дисплазия низкой степени выраженности вызывает минимальный архитектурный беспорядок и цитологическую атипию от легкой до умеренной степени. Интраэпителиальная неоплазия / дисплазия высокой степени включает опухолевые клетки, которые обычно являются кубоидальными, а не столбчатыми, с высоким отношением ядра к цитоплазме, выраженными амфофильными ядрышками, более выраженным архитектурным беспорядком и многочисленными митозами, которые могут быть нетипичными. Важно отметить, что ядра часто простираются в просветную сторону клетки, и полярность ядра обычно теряется. Большинство пациентов с поражениями, классифицированными как дисплазия высокой степени тяжести (HGD), подвержены высокому риску либо синхронной инвазивной карциномы, либо ее быстрого развития. Интравазозная инвазивная неоплазия / внутрислизистая карцинома определяет карциномы, которые проникают в собственную пластинку слизистой оболочки и отличаются от интраэпителиальной неоплазии / дисплазии не только десмопластическими изменениями, которые могут быть минимальными или отсутствующими, но также и различными структурными аномалиями, такими как выраженное скопление желез, скученность, чрезмерное ветвление и слитые или ситообразные железы. Диагноз карциномы слизистой оболочки означает, что существует повышенный риск лимфатической инвазии и метастазирования лимфатических узлов, хотя при определенных особенностях этот риск отсутствует или минимален. Предраковые и ранние поражения желудка
Рекомендация 5 (MAPS II). У пациентов с эндоскопически определяемыми патологическими изменениями, указывающими на дисплазию легкой или тяжелой степени или карциному, следует определить стадию заболевания и начать лечение (высокий уровень доказательности, сильная рекомендация). 4 Диагностика и постановка Эндоскопия
Рекомендация 6 (MAPS II). Эндоскопия высокого разрешения в сочетании с хромоэндоскопией более эффективна, чем эндоскопия высокого разрешения в белом свете, при диагностике предраковых состояний желудка и неопластических поражений на ранней стадии (высокий уровень доказательности).
Рекомендация 7 (MAPS II). При наличии возможности и после надлежащего обучения для диагностики предраковых состояний желудка следует применять виртуальную хромоэндоскопию с увеличением или без увеличения изображения, что позволяет выполнять контролируемую биопсию на участках атрофических и метапластических изменений, а также обеспечивает выявление неопластических поражений (умеренный уровень доказательности, сильная рекомендация). Взятие биопсии
Рекомендация 8 (MAPS II). Для надлежащего определения стадии предраковых состояний желудка первая диагностическая эндоскопия верхнего отдела желудочно-кишечного тракта должна включать взятие биопсийных образцов из желудка для определения наличия инфекции Helicobacter pylori и выявления атрофического гастрита на поздних стадиях (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 9 (MAPS II). Следует выполнить биопсию как минимум на двух топографических участках (по малой и большой кривизне, как в антральном отделе желудка, так и в теле желудка). Следует дополнительно выполнить биопсию видимых предполагаемых неопластических поражений (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 10 (MAPS II). Для выявления пациентов с гастритом на поздних стадиях можно использовать системы гистопатологического определения стадии заболевания (например, оперативную систему оценки гастрита (OLGA) и оперативную систему оценки гастрита, основанную на кишечной метаплазии (OLGIM)). Стадии III и IV могут указывать на пациентов, подверженных более высокому риску развития рака желудка. Следует рассмотреть возможность выполнения дополнительной биопсии из угла желудка (умеренный уровень доказательности, слабая рекомендация). Данный подход позволяет обеспечить максимальную степень выявления пациентов с предраковыми состояниями, в особенности в случаях, когда применение хромоэндоскопии для прицельной биопсии невозможно . Неинвазивная оценка
Рекомендация 11 (MAPS II). Низкие уровни пепсиногена I в сыворотке и/или низкое соотношение пенсиногенов I/II выявляют пациентов с продвинутыми стадиями атрофического гастрита, и для этих пациентов рекомендуется эндоскопия, особенно если серологический тес на Н.pylori был отрицательный. Дополнительные факторы риска
Рекомендация 12 (MAPS II). Несмотря на то, что в различных исследованиях оценивались возраст, пол и факторы вирулентности H. pylori , а также генетические вариации хозяина, для целенаправленного ведения на основе этих факторов не может быть сделано никаких клинических рекомендаций относительно диагностики и наблюдения (низкий уровень доказательности, слабая рекомендация) Наблюдение Дисплазия
Рекомендация 13 (MAPS II). У пациентов с дисплазией при отсутствии эндоскопически определенного очага рекомендуется немедленная высококачественная эндоскопическая переоценка с помощью хромоэндоскопии (виртуальной или на основе красителя). Если в этой высококачественной эндоскопии поражение не обнаружено, рекомендуется биопсия для постановки гастрита (если не было сделано ранее) и эндоскопического наблюдения в течение от 6 месяцев (при дисплазии высокой степени) до 12 месяцев (при дисплазии низкой степени). (низкий уровень доказательности, сильная рекомендация) Атрофический гастрит / кишечная метаплазия
Рекомендация 14 (MAPS II). Для пациентов с атрофией легкой и средней степени тяжести, ограниченной антральным отделом, нет никаких оснований рекомендовать наблюдение. (умеренный уровень доказательности, сильная рекомендация)
Рекомендация 15 (MAPS II). Пациенты с IM в одном месте имеют более высокий риск рака желудка. Однако этот повышенный риск не оправдывает наблюдения в большинстве случаев, особенно если высококачественная эндоскопия с биопсией исключает поздние стадии атрофического гастрита. (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 16 (MAPS II). У пациентов с кишечный метаплазией в одном месте, но с семейным анамнезом рака желудка, или с неполным IM, или с персистирующим гастритом H. pylori , можно рассмотреть эндоскопическое наблюдение с хромоэндоскопией и биопсией под контролем через 3 года. (низкий уровень доказательности, слабая рекомендация). Рекомендация 17 (MAPS II). Пациентам с поздними стадиями атрофического гастрита (тяжелые атрофические изменения или киш. метаплазия в антральном отделе и корпусе, OLGA / OLGIM III / IV) следует проводить высококачественную эндоскопию каждые 3 года. (низкий уровень доказательности, сильная рекомендация).
Рекомендация 18 (MAPS II). Пациенты с поздними стадиями атрофического гастрита и семейным анамнезом рака желудка могут выиграть от более интенсивного наблюдения (например, каждые 1-2 года после постановки диагноза). (низкий уровень доказательности, слабая рекомендация). Аутоиммунный гастрит Рекомендация 19 (MAPS II). Пациентам с аутоиммунным гастритом может быть полезно эндоскопическое наблюдение каждые 3 — 5 лет. (низкий уровень доказательности, слабая рекомендация). Терапия Ликвидация Helicobacter pylori
Рекомендация 20 (MAPS II). Эрадикация H. pylori лечит неатрофический хронический гастрит, может привести к регрессии атрофического гастрита и снижает риск рака желудка у пациентов с неатрофическим и атрофическим гастритом, и, следовательно, рекомендуется для пациентов с этими состояниями. (высокий уровень доказательности, сильная рекомендация).
Рекомендация 21 (MAPS II). У пациентов с установленной кишечной метаплазией эрадикация H. pylori , по-видимому, не значительно снижает риск рака желудка, по крайней мере, в краткосрочной перспективе, но уменьшает воспаление и атрофию, и, следовательно, это следует учитывать. (низкий уровень доказательности, слабая рекомендация). Рекомендация 22 (MAPS II). Эрадикация H. pylori рекомендуется для пациентов с желудочной неоплазией после эндоскопической терапии. (высокий уровень доказательности, сильная рекомендация). Другие методы лечения
Рекомендация 23 (MAPS II). Хотя ингибиторы циклооксигеназы (ЦОГ) -1 или ЦОГ-2 могут замедлять развитие предраковых состояний желудка, их нельзя рекомендовать специально для этой цели. (низкий уровень доказательности, слабая рекомендация). Рекомендация 24 (MAPS II). Низкие дозы аспирина в день могут рассматриваться для профилактики различных видов рака, включая рак желудка, у отдельных пациентов. (умеренный уровень доказательности, слабая рекомендация). Экономическая эффективность наблюдения и скрининга
Рекомендация 25 (MAPS II). В регионах от среднего до высокого риска выявление и наблюдение пациентов с предраковыми состояниями желудка является экономически эффективным. (умеренный уровень доказательности)