- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Обзор. Стратегии клинического наблюдения после эндоскопического лечения зубчатых аденом толстой и прямой кишки
| Авторы: | Аникина М.С. 1 2019г. |
| Об авторах: |
1. Врач-эндоскопист ГБУЗ НСО «Государственная Новосибирская областная клиническая больница» |
Аннотация:
Своевременная диагностика и правильное лечение зубчатых образований толстой и прямой кишки — крайне важные задачи из-за гистологической гетерогенности этих образований, специфических клинических и молекулярных моделей. Иногда зубчатые образования пропускают при рутинной колоноскопии, и, возможно, они вовлечены в генез интервальных раков. Наблюдение за пациентами с такими образованиями — еще одна горячая тема современной эндоскопии, учитывая, что клиническое значение зубчатых образований неправильно понималось в течение длительного времени. Заболеваемость интервальным колоректальным раком (КРР) подчеркивает наличие некоторых недостатков в текущих программах скрининга и последующего наблюдения. Учитывая отсутствие широкого консенсуса в отношении клинического наблюдения за некоторыми зубчатыми образованиями, мы попытаемся обобщить и уточнить существующие на сегодняшний день стратегии.
Введение:
Исследования в области биологии рака и его профилактики привели к концепции, что КРР на самом деле — гетерогенное заболевание, развивающееся из разных типов «предшественников» и по крайней мере через три различные молекулярных структуры [6].
Около 50‒70% КРР возникают из обычных аденом и микросателлитно стабильны [7].
Тем не менее несмотря на то, что злокачественный потенциал аденоматозных полипов неоспорим, более поздние исследования доказали, что 10‒30% КРР развиваются по другой схеме. С генетической точки зрения эти виды рака характеризуются высоким уровнем микросателлитной нестабильности, ядерным гиперметилированием и/или мутацией BRAF. С клинической и гистологической точки зрения эти раки возникают из так называемых зубчатых поражений, а путь канцерогенеза назван зубчатым [8, 9].

Полный текст статьи:
Стратегии клинического наблюдения после эндоскопического лечения зубчатых аденом толстой и прямой кишки
Аникина М.С., ГБУЗ НСО «Государственная Новосибирская областная клиническая больница», 2019 год
Текущая таксономия зубчатых образований. По данным Всемирной организации здравоохранения (ВОЗ) [10], зубчатые образования в настоящее время разделены на три подтипа (рис. 1): гиперпластические полипы (HP), зубчатые аденомы/полипы на широком основании — недиспластические и диспластические (SSA/P) и традиционные зубчатые аденомы (TSA). Эта классификация основана на их гистологических особенностях. Гистологически SSA/P характеризуются особой формой основания крипт в виде перевернутой буквы Т (якорь) или буквы L (сапог) [11, 12]. Согласно классификации ВОЗ, по крайней мере три крипты (или две смежные крипты) должны иметь эти особенности для постановки диагноза SSA/P, в то время как, согласно Американской гастроэнтерологической ассоциации, достаточно одной такой крипты [13]. Это несоответствие может вызвать значительное влияние на распространенность SSA/P [6].

Рисунок 1. Ямочный рисунок зубчатых образований толстой кишки, по T. Kimura (2012) [14]. II тип ямочного рисунка и подтипы архитектуры поверхности зубчатых поражений толстой и прямой кишки.
A — обычный тип II: регулярные, равномерные звездчатые ямки.
B — тип II-О (Open): звездчатые ямки, похожие на обычные ямки типа II, но с расширенными устьями железистых крипт.
C — тип II-L (Long): похожи на тип II, только удлиненные и без дилатации.
D — тип IV-S (Serrated), или «сосновая шишка».
E‒I — смешанные ямочные рисунки (E — тип II + IV-S; F — тип II-L + IV-S; G — тип II-O + II-L; H — тип II-O + IV-S; I — тип IV-S + II-L).
Эндоскопическая тактика в отношении зубчатых образований толстой кишки
Не существует четкого консенсуса относительно надлежащей стратегии лечения и последующего наблюдения за зубчатыми образованиями толстой и прямой кишки [6].
Наиболее распространенные зубчатые образованиями со злокачественным потенциалом — SSA/P. На их долю приходится 15–25% всех зубчатых образований толстой кишки [15]. SSA/P были обнаружены в 9% скрининговых колоноскопий [16]. Обнаружение SSA/P требует хорошей подготовки кишечника и высокой клинической настороженности. Любое качество подготовки кишечника ниже высокого связано со значительным снижением частоты обнаружения SSA/P. Несмотря на то, что удовлетворительная подготовка (BBPS 2-2-2) достаточна для обнаружения аденом, эти уровни неадекватны для обнаружения SSA/P [17]. Одноэтапная схема подготовки накануне вечером использоваться не должна [18]! Было проведено исследование, посвященное частоте выявления именно SSA/P при подготовке полнообъемным полиэтиленгликолем и малообъемным полиэтиленгликолем с аскорбатным комплексом (МОВИПРЕП®), подготовка во всех случаях проводилась в разделенной дозе. При равной частоте адекватной подготовки выявление SSA/P было достоверно выше в группе пациентов, принимавших МОВИПРЕП® (11,9% против 7,9%, Р = 0,005) [19].
Полиэтиленгликоль с аскорбатным комплексом (МОВИПРЕП®) лучше переносится, вызывая достоверно меньше нежелательных явлений в виде тошноты и рвоты. Применение сплит-дозы малообъемного препарата ПЭГ с аскорбатным комплексом (МОВИПРЕП®) — эффективный, безопасный и комфортный метод подготовки толстой кишки к колоноскопии. Отмечено, что большая доля пациентов оценила МОВИПРЕП® как более удобный по сравнению со стандартным полиэтиленгликолем объемом 4 л, а также большая доля пациентов готова принимать повторно МОВИПРЕП®, а не препарат на основе ПЭГ объемом 4 л [20‒23].
Также на частоту выявления SSA/P влияет время выведения колоноскопа. Каждая дополнительная минута свыше 6 минут увеличивает вероятность обнаружения данного типа образований, оптимальное время выведения — не менее 9 минут [24]. Осмотр восходящей кишки в ретрофлексии также повышает частоту выявления SSA/P [24].
Как правило, рекомендуется удалить все зубчатые образования, за исключением небольших (<5 мм) в ректосигмоидном отделе, которые при множественности могут быть случайным образом отобраны для гистологии [13]. Методы резекции и показания могут варьировать в зависимости от центра, а также от опыта и предпочтений эндоскопистов [6, 24].
Для небольших зубчатых образований (<10 мм), расположенных в правой половине толстой кишки, могут быть использованы стандартные методы полипэктомии — в частности, холодная петлевая резекция [25] зарекомендовала себя как безопасный и эффективный метод [26] наряду с коагуляционными методами (рис. 2). Для удаления плоских зубчатых образований широко используется метод эндоскопической резекции слизистой.
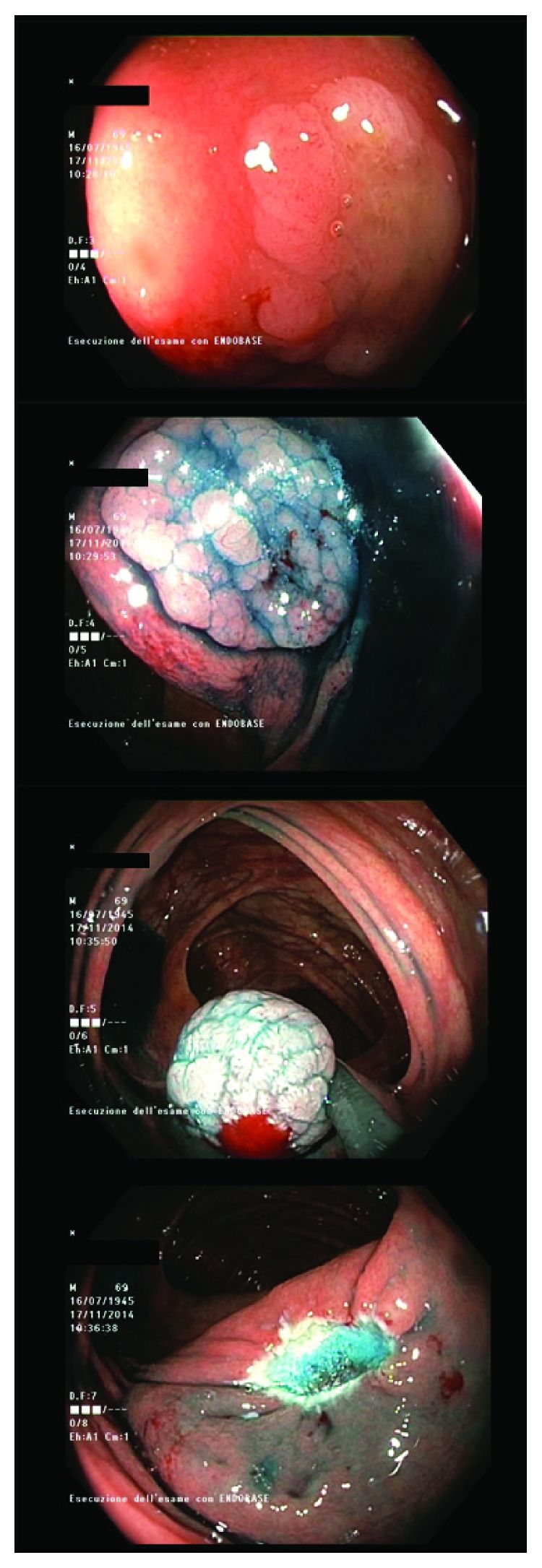
Рисунок 2. Различные этапы удаления зубчатой аденомы размером 1,5 см: от гидролифтинга до резекции с помощью диатермической петли [6].
При образованиях размером ≥10 мм выбор подходящего метода зависит как от особенностей образования, так и от навыков эндоскописта. В основном рекомендуется следовать современным тенденциям и рекомендациям по лечению крупных неполиповидных колоректальных образований с несколько расширенными показаниями к холодной петлевой резекции слизистой и резекции слизистой методом кускования для удаления SSA/P без дисплазии [6, 24]. Резекция по частям также технически проще при образованиях размером >20 мм [27]. Необходимо отметить, что после гидролифтинга зубчатого образования его края становятся менее заметны [28]. Эти технические аспекты могут стать причиной более высокой частоты неполной резекции SSA/P по сравнению с обычными аденомами — и в некоторой степени причиной интервальных раков. Контрольную колоноскопию рекомендуется провести через 3‒6 месяцев после первой процедуры, чтобы убедиться, что иссечение было завершено, имея в виду потенциально более высокий риск рецидива зубчатого образования [27].
Наблюдение после полной резекции зубчатых образований
Пациентам с зубчатыми образованиями толстой и прямой кишки настоятельно рекомендуется эндоскопическое наблюдение. Учитывая роль данных образований в генезе интервального КРР, наблюдение предполагает небольшие интервалы между колоноскопиями [30].
Рекомендации по программам эпиднадзора основаны, как правило, на экспертных заключениях, а не на качественных доказательствах. В таблице 1 представлены рекомендации по программам эпиднадзора за зубчатыми поражениями в соответствии с наиболее важными международными экспертными обществами.
Таблица 1. Опубликованные рекомендации по наблюдению после полного удаления зубчатых образований толстой и прямой кишки [15].
|
|
Рекомендуемые интервалы наблюдения
| ||||||||
|
Выявленный полип |
Определение |
International Serrated Consensus Panel [13] |
United States Multi–Society Task Force [29] |
British Society of Gastroenterology [32] |
European Union Guidelines [33] |
European Society of Gastrointestinal Endoscopy [34] |
Japanese Society of Gastroenterology6 [35] |
Korean Multi-Society Task Force [36] |
Cancer Council of Australia8 [37] |
|
Аденома низкого риска |
1–2 обычные аденомы |
Нет рекомендаций |
5–10 лет |
5–10 лет |
Обычный скрининг |
Обычный скрининг |
3–10 лет |
5 лет |
5 лет |
|
Аденома высокого риска |
Обычные аденомы, ≥3 шт. размером ≥10 мм, или ворсинчатые, или HGD |
Нет рекомендаций |
3 года |
1–3 года1 |
1–3 года1 |
3 года |
3 года |
3 года |
3 года |
|
НР низкого риска |
Малые НР ≤10 мм в ректосигмоидном отделе |
10 лет |
10 лет |
Нет наблюдения |
Обычный скрининг |
Обычный скрининг |
Нет рекомендаций |
Нет рекомендаций |
10 лет |
|
1–3 малых НР <6 мм в проксимальных отделах |
10 лет |
Нет рекомендаций |
Нет наблюдения |
Нет рекомендаций |
Обычный скрининг |
Нет рекомендаций |
Нет рекомендаций |
Нет рекомендаций | |
|
Зубчатые образования среднего риска |
Крупный (≥10 мм) НР |
5 лет |
Нет рекомендаций |
Нет наблюдения |
Нет рекомендаций |
3 года |
Нет рекомендаций |
3 года7 |
Нет рекомендаций |
|
>3 проксимальных НР |
5 лет |
Нет рекомендаций |
Нет наблюдения |
Нет рекомендаций |
Обычный скрининг |
Нет рекомендаций |
Нет рекомендаций |
Нет рекомендаций | |
|
1–2 SSA/P, <10 мм |
5 лет |
5 лет |
Нет наблюдения |
Нет рекомендаций |
Обычный скрининг |
Нет рекомендаций |
Нет рекомендаций |
5 лет | |
|
Зубчатые образования высокого риска |
Крупные (≥10мм) SSA/P |
3 года |
3 года |
3 года |
Нет рекомендаций |
3 года |
Нет рекомендаций |
3 года |
3 года |
|
SSA/P ≥3 шт. |
3 года |
3–5 лет |
Нет наблюдения |
Нет рекомендаций |
Обычный скрининг |
Нет рекомендаций |
Нет рекомендаций |
3 года | |
|
SSA/P с цитологической дисплазией |
1–3 лет |
3 года |
3 года |
Нет рекомендаций |
3 года |
Нет рекомендаций |
Нет рекомендаций |
5 лет8 | |
|
TSA |
3–5 лет2 |
3 года |
3 года |
1–10 лет3 |
3 года4 |
Нет рекомендаций |
3–5 лет7 |
3–5 лет | |
|
Синдром зубчатого полипоза |
Критерии ВОЗ (см. в тексте) |
1 год |
1 год |
1–2 года |
Нет рекомендаций |
Нет рекомендаций5 |
Нет рекомендаций |
Нет рекомендаций |
Нет рекомендаций |
Условные обозначения ##под таблицей##
Нет рекомендаций — рекомендации отсутствуют, или они неспецифичны
ВОЗ — Всемирная организация здравоохранения
HGD (high grade dysplasia) — дисплазия высокой степени
HP — гиперпластический полип
SSA/P — зубчатая аденома/полип на широком основании
TSA — традиционная зубчатая аденома
1 Британские и EU-рекомендации стратифицируют аденомы высоких рисков на аденомы более высокого среднего риска (3–4 маленькие аденомы <20 мм, интервал наблюдения — 3 года) и аденомы высокого риска (≥5 обычных аденом или любое количество аденом ≥20 мм, интервал наблюдения — 1 год).
2 Consensus Panel рекомендует трехлетний интервал наблюдения для крупных или множественных (≥3 шт.) TSA.
3 Согласно рекомендациям EU, принципы удаления и наблюдения при TSA те же, что и для обычных аденом с рекомендуемым интервалом наблюдения от 1 до 10 лет в зависимости от размера и множественности.
4 ESGE рекомендует трехлетний интервал наблюдения для любых зубчатых образований ≥10 мм (HP, SSA/P или TSA). Руководство является неоднозначным в отношении принципов лечения и наблюдения при малых или недиспластичных TSA.
5 ESGE признает зубчатый полипозный синдром и рекомендует направление таких пациентов на генетическое консультирование, но не определяет конкретный интервал наблюдения.
6 Японское общество гастроэнтерологов не рекомендует резекцию диминутивных полипов (диаметром ≤5 мм) независимо от предполагаемой гистологии. После удаления любой аденомы рекомендуется трехлетний интервал наблюдения.
7 Согласно Корейским рекомендациям, необходим трехлетний интервал наблюдения любых зубчатых образований размерами ≥10 мм (HP, SSA/P или TSA). Маленькие (<10 мм) TSA относятся к категории низкого риска (интервал наблюдения — 5 лет).
8 Согласно Австралийским рекомендациям, подходы к лечению SSA/P и TSA не отличаются от рекомендаций для обычных аденом с 3–5-летним интервалом наблюдения в зависимости от множественности и размеров. Только дисплазия высокой степени (редкая в SSA/P) считается высокой степенью риска.
На основании гистологического строения, размеров, локализации и множественности зубчатые образования принято разделять по степени риска развития КРР на образования с низким, средним и высоким риском.
Зубчатые образования с низким риском развития КРР
Диминутивные НР в ректосигмоидом отделе не считаются маркерами риска развития КРР [33, 34]. В то же время недостаточно понятно, являются ли один или два проксимально расположенных малых или диминутивных HP или SSA/P маркерами риска развития КРР. Исследования, посвященные риску развития КРР, показали, что наибольший риск связан с более крупными образованиями [25]. Таким образом, к зубчатым образованиям с низким злокачественным потенциалом относятся диминутивные и малые НP (<10 мм) ректосигмоидного отдела и прямой кишки, а также 1‒3 НР размерами <6 мм в проксимальных отделах [15]. Интервал наблюдения таких пациентов идентичен общепопуляционному скринингу КРР.
При этом следует учитывать, что чем меньше размер образования, тем сложнее дифференциальная диагностика НР и SSA/P на основании гистологического исследования, поэтому параметры наблюдения могут быть индивидуализированы.
Зубчатые образования со средним риском развития КРР
Исследование, включившее 3121 бессимптомного пациента в возрасте 50‒75 лет, прошедшего скрининговую колоноскопию, и 1371 — последующее наблюдение, выявило, что три или более проксимальных недиспластических зубчатых полипа являются независимым предиктором синхронной прогрессирующей неоплазии [31]. В целом, данные о существенном повышении рисков развития КРР у пациентов с малыми SSA/P ограниченны.
SSA/P размерами <10 мм, особенно у молодых пациентов, могут представлять собой неполную фенотипическую экспрессию синдрома зубчатого полипоза, поэтому параметры наблюдения также могут быть индивидуализированы [25].
К образованиям со средним риском развития КРР относят НР >10 мм в ректосигмоидном отделе и прямой кишке, >3 проксимальных НР и 1‒2 SSA/P размерами <10 мм. Рекомендуемый интервал наблюдения составляет 5 лет [15].
Образования с высоким риском развития КРР
Обнаружение любого образования SSA/P делает более вероятным выявление как синхронных, так и метахронных неоплазий толстой кишки [38‒42]. При этом риск выявить синхронную прогрессирующую неоплазию выше при SSA/P ≥10 мм [31, 43]. Наряду с этим SSA/P ≥10 мм чаще бывают диспластическими. Риск развития дисплазии в SSA/P увеличивается с возрастом пациента. Данные наблюдений свидетельствуют о том, что частота развития дисплазии низкой степени составляет 12%, а высокой — 2% и как минимум 6% SSA/P прогрессируют в КРР [44, 45]. Точные сроки прогрессии SSA/P без цитологической дисплазии в рак — предмет горячих дебатов. На сегодняшний день считается, что этот интервал составляет 15 лет, хотя точно это не установлено [11, 25]. В большинстве современных руководств интервал наблюдения при недиспластических SSA/P ≥10 мм составляет 3 года [25].
TSA также способны к злокачественному преобразованию, но, учитывая их относительную редкость, они менее изучены по сравнению с другими зубчатыми полипами [46]. Крупное датское популяционное исследование выявило, что 10-летний риск развития КРР для пациентов с диспластическими SSA/P составляет 4,4%, для пациентов с TSA — 4,5% против 2,3% у пациентов с обычными аденомами [30].
Таким образом, к зубчатым образованиям с высоким риском развития КРР относят SSА/P ≥10 мм, SSА/P любых размеров в количестве ≥3, SSА/P с цитологической дисплазией и TSA. Рекомендуемый интервал наблюдения для них, согласно большинству современных руководств, составляет 3 года [15, 25].
Синдром зубчатого полипоза
Первоначально синдром зубчатого полипоза (SPS, serrated polyposis syndrome) был описан для того, чтобы отделить это понятие от семейного аденоматозного полипоза, так как считалось, что SPS не повышает риск КРР [47]. Однако благодаря Торлаковичу и Сноверу, которые в 1996 году описали серию случаев синдрома зубчатого полипоза, связанных с КРР, это было оспорено [48]. Дальнейшие исследования подтвердили связь этого синдрома с КРР [49‒52].
На сегодняшний день диагноз «синдром зубчатого полипоза» ставится в соответствии с критериями ВОЗ 2010 года.
|
Синдром зубчатого полипоза, критерии ВОЗ (2010) [53]: 1) по крайней мере 5 зубчатых полипов, проксимальных к сигмовидной кишке, 2 из которых имеют диаметр >10 мм; 2) любое количество зубчатых полипов, встречающихся проксимально к сигмовидной кишке у индивидуума, у которого есть родственник первой степени с зубчатым полипозом; 3) более 20 зубчатых полипов любого размера, распределенных по всей толстой кишке. |
Зубчатое поражение относится к любой комбинации НР и SSA/P. Синдром зубчатого семейного полипоза должен быть выставлен при наличии хотя бы одного критерия.
Оценки распространенности SPS в популяции традиционно были очень низкими — 1:100 000, однако распространенность может оказаться значительно выше. При скрининге на основе анализа кала на скрытую кровь она составляет 1:300, а в программах скрининговой колоноскопии — приблизительно 1:2000, что делает этот синдром важным для выявления эндоскопистами в этих программах [25, 54‒58].
Учитывая множественность полипов и высокий риск КРР, доказательства семейной кластеризации, ассоциированную семейную историю КРР в 50% случаев носителей SPS, а также повышенный риск КРР у родственников первой степени, были предприняты согласованные усилия по поиску генетической причины синдрома зубчатого полипоза. Гены (и ассоциированные синдромы), ассоциированные с фенотипом SPS, включают: MUTYH (MAP); BMPR1A (синдром ювенильного полипоза) [59]; SMAD4 (синдром ювенильного полипоза) [60, 61]; PTEN (синдром Коуден) [62]; GREM1 (синдром наследственного смешанного полипоза) [63]; RNF43 (множественные зубчатые полипы) [64]. В то же время никаких общих генетических факторов для большинства случаев SPS не определено [65]. Диагноз «синдром зубчатого полипоза» основывается на критериях ВОЗ (2010). На сегодняшний день у носителей SPS не отмечено связи с опухолями верхних отделов желудочно-кишечного тракта или раками внекишечных локализаций. Но, учитывая фенотипический перекрест с другими наследственными мультиопухолевыми синдромами, всем пациентам с клиническим диагнозом SPS рекомендовано медико-генетическое исследование на специализированный регистр полипозов для исключения альтернативных диагнозов [25].
Лечение пациентов с синдромом зубчатого полипоза эндоскопическое, в хирургическом лечении нуждается относительно небольшое число пациентов. Это случаи обнаружения рака либо случаи, когда размер или локализация образования не позволяют провести эндоскопическую резекцию. Большинство пациентов с SPS после удаления большей части образований не нуждаются в оперативном лечении в течение срока наблюдения до 5 лет. Также необходимо обследовать родственников первой линии для выявления у них синдрома зубчатого полипоза. После удаления полипов интервал наблюдения для носителей SPS составляет 1 год [25].
Выводы
Зубчатые образования на основании гистологического строения, размеров, локализации и множественности разделены на группы риска развития КРР. К образованиям низкого риска относятся НР (<10 мм) ректосигмоидного отдела и прямой кишки и 1‒3 НР размерами <6 мм в проксимальных отделах. Пациенты с данными образованиями в особом скрининге не нуждаются. К образованиям средней группы риска относятся НР >10 мм в ректосигмоидном отделе и прямой кишке, >3 проксимальных НР и 1‒2 SSA/P размерами <10 мм. Рекомендуемый интервал наблюдения в этой группе составляет 5 лет. Образования высокого риска представлены SSА/P ≥10 мм, SSА/P любых размеров в количестве ≥3, SSА/P с цитологической дисплазией и TSA. Рекомендуемый интервал наблюдения, согласно большинству современных руководств, составляет 3 года. Кроме этого, к группе высокого риска развития КРР относятся пациенты с синдромом зубчатого полипоза. Данный диагноз ставится клинически на основании критериев ВОЗ: по крайней мере пять зубчатых полипов, проксимальных к сигмовидной кишке, два из которых имеют диаметр >10 мм, и/или любое количество зубчатых полипов, встречающихся проксимально к сигмовидной кишке у индивидуума, у которого есть родственник первой степени с зубчатым полипозом, и/или более 20 зубчатых полипов любого размера, распределенных по всей толстой кишке. Для постановки диагноза достаточно хотя бы одного критерия. Пациенты с синдромом зубчатого полипоза нуждаются в обязательном медико-генетическом консультировании для исключения других наследственных полипозных синдромов. После удаления образований толстой кишки пациенты нуждаются в ежегодных контрольных осмотрах. После удаления зубчатого образования на широком основании, особенно методом кускования, необходим контрольный осмотр через 3‒6 месяцев для исключения рецидива в результате неполного удаления.
Вам может быть интересно:
Классификация WASP: видео-практикум
Список литературы:
1. Lane N. The precursor tissue of ordinary large bowel cancer. Cancer Research. 1976. (36, 7: Part 2): 2669–2672.
2. Urbanski S.J., Kossakowska A.E., Marcon N., Bruce W.R. Mixed hyperplastic adenomatous polyps–an underdiagnosed entity. Report of a case of adenocarcinoma arising within a mixed hyperplastic adenomatous polyp. The American Journal of Surgical Pathology. 1984. 8 (7): 551–556. DOI: 10.1097/00000478-198407000-00008.
3. Jaramillo E., Watanabe M., Rubio C., Slezak P. Small colorectal serrated adenomas: endoscopic findings. Endoscopy. 1997. 29 (1): 1–3. DOI: 10.1055/s-2007-1004052.
4. Longacre T.A., Fenoglio-Preiser C.M. Mixed hyperplastic adenomatous polyps/serrated adenomas. A distinct form of colorectal neoplasia. The American Journal of Surgical Pathology. 1990;14(6):524–537. DOI: 10.1097/00000478-199006000-00003.
5. Choi E.Y.K., Appelman H.D. A historical perspective and exposé on serrated polyps of the colorectum. Archives of Pathology & Laboratory Medicine. 2016. 140 (10): 1079–1084. DOI: 10.5858/arpa.2016-0278-RA.
6. Cassese G., Amendola A., Maione F., Giglio M.C., Pagano G., Milone M., Aprea G., Luglio G., De Palma G.D. Serrated Lesions of the Colon-Rectum: A Focus on New Diagnostic Tools and Current Management. Gastroenterol Res Pract. 2019. Jan 10; 2019: 9179718. DOI: 10.1155/2019/9179.
7. Kinzler K.W., Vogelstein B. Life (and death) in a malignant tumour. Nature. 1996. 379 (6560): 19–20. DOI: 10.1038/379019a0.
8. Sweetser S., Smyrk T.C., Sugumar A. Serrated polyps: critical precursors to colorectal cancer. Expert Review of Gastroenterology & Hepatology. 2014. 5 (5): 627–635. DOI: 10.1586/egh.11.67.
9. Huang C.S., Farraye F.A., Yang S., O’Brien M.J. The clinical significance of serrated polyps. The American Journal of Gastroenterology. 2011. 106 (2): 229–240. DOI: 10.1038/ajg.2010.429.
10. Bosman F.T., Carneiro F., Hruban R.H., Theise N.D. International Agency for Research on Cancer. 4th. Vol. 3. World Health Organization, 2010. WHO classification of tumours of the digestive system.
11. Lash R.H., Genta R.M., Schuler C.M. Sessile serrated adenomas: prevalence of dysplasia and carcinoma in 2139 patients. J Clin Pathol. 2010. 63: 681–686.
12. Snover D.C. Update on the serrated pathway to colorectal carcinoma. Hum Pathol. 2011. 42: 1–10.
13. Rex D.K., Ahnen D.J., Baron J.A., Batts K.P., Burke C.A., Burt R.W., et al. Serrated lesions of the colorectum: review and recommendations from an expert panel. Am J Gastroenterol. 2012. 107: 1315–1329. DOI: 10.1038/ajg.2012.161.
14. Kimura T., Yamamoto E., Yamano H.O., Suzuki H., Kamimae S., Nojima M., Sawada T., Ashida M., Yoshikawa K., Takagi R., et al. A novel pit pattern identifies the precursor of colorectal cancer derived from sessile serrated adenoma. Am J Gastroenterol. 2012. 107: 460–469.
15. O’Connell B.M., Crockett S.D. The clinical impact of serrated colorectal polyps. Clin Epidemiol. 2017. Feb 22; 9: 113–125. eCollection 2017. PMID: 28260946. PMCID: PMC5327852. DOI: 10.2147/CLEP.S106257.
16. Spring K.J., Zhao Z.Z., Karamatic R., Walsh M.D., Whitehall V.L., Pike T. et al. High prevalence of sessile serrated adenomas with BRAF mutations: a prospective study of patients undergoing colonoscopy. Gastroenterology. 2006. 131 (5): 1400–1407.
17. Clark B.T., Laine L. High-quality bowel preparation is required for detection of sessile serrated polyps. Clin Gastroenterol Hepatol. 2016. 14: 1155–1162. DOI: 10.1016/j.cgh.2016.03.044.
18. Hassan C., Bretthauer M., Kaminski M.F., Polkowski M., Rembacken B., Saunders B., Benamouzig R., Holme O., Green S., Kuiper T., Marmo R., Omar M., Petruzziello L., Spada C., Zullo A., Dumonceau J.M.; European Society of Gastrointestinal Endoscopy. Bowel preparation for colonoscopy: European Society of Gastrointestinal Endoscopy (ESGE) guideline. Endoscopy. 2013. 45 (2): 142–150. Epub 2013 Jan 18. PMID: 23335011. DOI: 10.1055/s-0032-1326186.
19. Siddiki H., Ravi S., Al-Qaisi M.T., Fath A.R., Ramirez F., Crowell M.D., Pannala R., Faigel D.O., Gurudu S.R. Comparison Versus Large Volume for Colonoscopy: A Study Outcomes. Dig Dis Sci. 2018 May 7. [Epub ahead of print]. PMID: 29736830. DOI: 10.1007/s10620-018-5102-8.
20. Kojecky V., Dastych M., Zadorova Z., Varga M., Hajer J., Kment M., Kroupa R., Kunovska M., Matous J., Misurec M., Hep A., Kianicka B., Latta J. [Effective bowel preparation before coloscopy — low-volume PEG in the divided dose regimen]. Vnitr Lek. 2016. Apr; 62 (4): 249–254. PMID: 27250601.
21. Xie Q., Chen L., Zhao F., Zhou X., Huang P., et al. (2014) A Meta-Analysis of Randomized Controlled Trials of Low-Volume Polyethylene Glycol plus Ascorbic Acid versus Standard-Volume Polyethylene Glycol Solution as Bowel Preparations for Colonoscopy. PLoS One.9 (6): e99092. DOI:10.1371/journal.pone.0099092.
22. Ponchon T. et al. A low-volume polyethylene glycol plus ascorbate solution for bowel cleansing prior to colonoscopy: the NORMO randomised clinical trial. Digestive and Liver Disease. 2013. Oct; 45 (10): 820–826. DOI: 10.1016/j.dld.2013.04.009. Epub 2013 Jun 14.
23. Ell C. et al. Randomized Trial of Low-Volume PEG Solution Versus Standard PEG + Electrolytes for Bowel Cleansing Before Colonoscopy. American Journal of Gastroenterology. 2008 Apr; 103 (4): 883–893.
24. Ma M.X., Bourke M.J. Sessile Serrated Adenomas: How to Detect, Characterize and Resect. Gut Liver. 2017. Nov 15; 11 (6): 747–760. PMID: 28494577. PMCID: PMC5669590. DOI: 10.5009/gnl16523.
25. East J. E., Atkin W. S., Bateman A. C., et al. British Society of Gastroenterology position statement on serrated polyps in the colon and rectum. Gut. 2017. 66 (7): 1181–1196. DOI: 10.1136/gutjnl-2017-314005.
26. Repici A., Hassan C., Vitetta E., et al. Safety of cold polypectomy for < 10 mm polyps at colonoscopy: a prospective multicenter study. Endoscopy. 2012. 44 (1): 27–31. DOI: 10.1055/s-0031-1291387.
27. Khashab M., Eid E., Rusche M., Rex D. K. Incidence and predictors of “late” recurrences after endoscopic piecemeal resection of large sessile adenomas. Gastrointestinal Endoscopy. 2009. 70 (2): 344–349. DOI: 10.1016/j.gie.2008.10.037.
28. Bordaçahar B., Barret M., Terris B., et al. Sessile serrated adenoma: from identification to resection. Digestive and Liver Disease. 2015. 47 (2): 95–102. DOI: 10.1016/j.dld.2014.09.006.
29. Lieberman D.A., Rex D.K., Winawer S.J., Giardiello F.M., Johnson D.A., Levin T.R., et al. Guidelines for colonoscopy surveillance after screening and polypectomy: a consensus update by the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology. 2012. 143: 844–857.
30. Erichsen R., Baron J. A., Hamilton-Dutoit S. J., et al. Increased risk of colorectal cancer development among patients with serrated polyps. Gastroenterology. 2016. 150 (4): 895–902.e5. DOI: 10.1053/j.gastro.2015.11.046.
31. Schreiner M.A., Weiss D.G., Lieberman D.A. Proximal and large hyperplastic and nondysplastic serrated polyps detected by colonoscopy are associated with neoplasia. Gastroenterology 2010. 139: 1497–1502. DOI: 10.1053/j.gastro.2010.06.074.
32. Cairns S.R., Scholefield J.H., Steele R.J., Dunlop M.G., Thomas H.J., Evans G.D., et al. Guidelines for colorectal cancer screening and surveillance in moderate and high risk groups (update from 2002). Gut. 2010. 59: 666–689.
33. Atkin W.S., Valori R., Kuipers E.J., Hoff G., Senore C., Segnan N., et al. European guidelines for quality assurance in colorectal cancer screening and diagnosis. First Edition – Colonoscopic surveillance following adenoma removal. Endoscopy. 2012. 44: SE151–SE163.
34. Hassan C., Quintero E., Dumonceau J.-M., Regula J., Brandao C., Chaussade S., et al. Post-polypectomy colonoscopy surveillance: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2013. 45: 842–864.
35. Tanaka S., Saitoh Y., Matsuda T., Igarashi M., Matsumoto T., Iwao Y., et al. Evidence-based clinical practice guidelines for management of colorectal polyps. J Gastroenterol. 2015. 50: 252–260.
36. Yang D.-H., Hong S.N., Kim Y.-H., Hong S.P., Shin S.J., Kim S.-E., et al. Korean Guidelines for Postpolypectomy Colonoscopy Surveillance. Clin Endosc. 2012. 45 (1): 44–61.
37. Summary of recommendations – Cancer Guidelines Wiki [Internet] [cited 2017 Apr 13]. Available from: http://wiki.cancer.org.au/australia/Guidelines:Colorectal_cancer/Colonoscopy_surveillance/Summary_of_recommendations.
38. Lu F.I., van Niekerk de W., Owen D., et al. Longitudinal outcome study of sessile serrated adenomas of the colorectum: an increased risk for subsequent right-sided colorectal carcinoma. Am J Surg Pathol 2010. 34: 927–934. DOI: 10.1097/PAS.0b013e3181e4f256.
39. Pai R.K., Hart J., Noffsinger A.E. Sessile serrated adenomas strongly predispose to synchronous serrated polyps in non-syndromic patients. Histopathology. 2010. 56: 581–588. DOI: 10.1111/j.1365-2559.2010.03520.x.
40. Lazarus R., Junttila O.E., Karttunen T.J., et al. The risk of metachronous neoplasia in patients with serrated adenoma. Am J Clin Pathol. 2005. 123: 349–359. DOI: 10.1309/VBAG-V3BR-96N2-EQTR.
41. Teriaky A., Driman D.K., Chande N. Outcomes of a 5-year follow-up of patients with sessile serrated adenomas. Scand J Gastroenterol. 2012. 47: 178–183. DOI: 10.3109/00365521.2011.645499.
42. Salaria S.N., Streppel M.M., Lee L.A., et al. Sessile serrated adenomas: high-risk lesions? Hum Pathol. 2012. 43: 1808–1814. DOI: 10.1016/j.humpath.2012.04.001.
43. Ng S.C., Ching J.Y., Chan V.C., et al. Association between serrated polyps and the risk of synchronous advanced colorectal neoplasia in average-risk individuals. Aliment Pharmacol Ther. 2015. 41: 108–115. DOI: 10.1111/apt.13003.
44. Hetzel J.T., Huang C.S., Coukos J.A., Omstead K., Cerda S.R., Yang S., et al. Variation in the detection of serrated polyps in an average risk colorectal cancer screening cohort. Am J Gastroenterol. 2010. 105: 2656–2664.
45. Huang C.S., Farraye F.A., Yang S., O’Brien M.J. The clinical significance of serrated polyps. Am J Gastroenterol. 2011. 106: 229–240.
46. Bettington M.L., Chetty R. Traditional serrated adenoma: an update. Hum Pathol Phila. 2015. 46: 933–938.
47. Williams G.T., Arthur J.F., Bussey H.J., et al. Metaplastic polyps and polyposis of the colorectum. Histopathology. 1980. 4: 155–170. DOI: 10.1111/j.1365-2559.1980.tb02909.x.
48. Torlakovic E., Snover D.C. Serrated adenomatous polyposis in humans. Gastroenterology. 1996. 110: 748–755. DOI: 10.1053/gast.1996.v110.pm8608884.
49. Boparai K.S., Mathus-Vliegen E.M., Koornstra J.J., et al. Increased colorectal cancer risk during follow-up in patients with hyperplastic polyposis syndrome: a multicentre cohort study. Gut 2010. 59: 1094–1100. DOI: 10.1136/gut.2009.185884.
50. Edelstein D.L., Axilbund J.E., Hylind L.M., et al. Serrated polyposis: rapid and relentless development of colorectal neoplasia. Gut. 2013. 62: 404–408. DOI: 10.1136/gutjnl-2011-300514.
51. IJspeert J.E., Rana S.A., Atkinson N.S., et al. Clinical risk factors of colorectal cancer in patients with serrated polyposis syndrome: a multicentre cohort analysis. Gut. 2017. 66: 278–284. DOI: 10.1136/gutjnl-2015-310630.
52. Carballal S., Rodriguez-Alcalde D., Moreira L., et al. Colorectal cancer risk factors in patients with serrated polyposis syndrome: a large multicentre study. Gut. 2016. 65: 1829–1837. DOI: 10.1136/gutjnl-2015-309647.
53. Snover D.C., Ahenen D.J., Burt R.W., et al. Serrated polyps of the colon and rectum and serrated polyposis. In: Bosman F.T., Carneiro F., Hruban R.H., Theise N.D. World Health Organisation Classification of tumours of the digestive system. Lyon: IARC Press, 2010.
54. Biswas S., Ellis A.J., Guy R., et al. High prevalence of hyperplastic polyposis syndrome (serrated polyposis) in the NHS Bowel Cancer Screening Programme. Gut. 2013. 62: 475. DOI: 10.1136/gutjnl-2012-303233.
55. Kahi C.J., Li X., Eckert G.J., et al. High colonoscopic prevalence of proximal colon serrated polyps in average-risk men and women. Gastrointest Endosc. 2012. 75: 515–520. DOI: 10.1016/j.gie.2011.08.021.
56. Lockett M., Atkin W.S. Hyperplastic polyposis: prevalence and cancer risk. Gut. 2001. 49 (Suppl 1): A4 [abstract].
57. Moreira L., Pellise M., Carballal S., et al. High prevalence of serrated polyposis syndrome in FIT-based colorectal cancer screening programmes. Gut. 2013. 62: 476–477. DOI: 10.1136/gutjnl-2012-303496.
58. Orlowska J., Kiedrowski M., Kaminski M.F. Hyperplastic polyposis syndrome in asymptomatic patients: the result from the colorectal-cancer screening program. Virchows Arch. 2009. 455 (Suppl 1): S47.
59. Cheah P.Y., Wong Y.H., Chau Y.P., et al. Germline bone morphogenesis protein receptor 1A mutation causes colorectal tumorigenesis in hereditary mixed polyposis syndrome. Am J Gastroenterol. 2009. 104: 3027–3033. DOI: 10.1038/ajg.2009.542.
60. Mongin C., Coulet F., Lefevre J.H., et al. Unexplained polyposis: a challenge for geneticists, pathologists and gastroenterologists. Clin Genet. 2012. 81: 38–46. DOI: 10.1111/j.1399-0004.2011.01676.x.
61. Heald B., Mester J., Rybicki L., et al. Frequent gastrointestinal polyps and colorectal adenocarcinomas in a prospective series of PTEN mutation carriers. Gastroenterology. 2010. 139: 1927–1933. DOI: 10.1053/j.gastro.2010.06.061.
62. Sweet K., Willis J., Zhou X.P., et al. Molecular classification of patients with unexplained hamartomatous and hyperplastic polyposis. JAMA. 2005. 294: 2465–2473. DOI: 10.1001/jama.294.19.2465.
63. Jaeger E., Leedham S., Lewis A., et al. Hereditary mixed polyposis syndrome is caused by a 40-kb upstream duplication that leads to increased and ectopic expression of the BMP antagonist GREM1. Nat Genet. 2012. 44: 699–703. DOI: 10.1038/ng.2263.
64. Gala M.K., Mizukami Y., Le L.P., et al. Germline mutations in oncogene-induced senescence pathways are associated with multiple sessile serrated adenomas. Gastroenterology. 2014. 146: 520–9. DOI: 10.1053/j.gastro.2013.10.045.
65. Clendenning M., Young J.P., Walsh M.D., et al. Germline mutations in the polyposis-associated genes BMPR1A, SMAD4, PTEN, MUTYH and GREM1 are not common in individuals with serrated polyposis syndrome. PLoS ONE. 2013. 8: e66705. DOI: 10.1371/journal.pone.0066705.
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.











.jpg)




.png)

















Комментарии