- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: УДАЛЕНИЕ ЗУБЧАТЫХ ОБРАЗОВАНИЙ ТОЛСТОЙ КИШКИ
| Авторы: | Аникина М.С. 1 2019г. |
| Об авторах: |
1. врач-эндоскопист ГБУЗ НСО «Государственная Новосибирская областная клиническая больница» |
Аннотация:
Зубчатые аденомы/полипы на широком основании, гиперпластические полипы и традиционные зубчатые аденомы образуют гетерогенную группу неоплазий, известных как зубчатые [1]. Гистологически эпителиальные крипты этих образований имеют общий зазубренный или пилообразный вид, причем каждый подтип определяется специфическими особенностями архитектуры, расположения и протяженности пролиферативной зоны [2]. Классификация зазубренных полипов эволюционировала с течением времени, отражая достижения в понимании их гистопатологических, морфологических и молекулярных особенностей [4, 5]. До начала века практически все зубчатые полипы назывались гиперпластическими, так как считалось, что эти поражения не малигнизируются и поэтому не имеют особого клинического значения [6, 7]. Это по-прежнему актуально для истинных НР, но SSA/P и TSA имеют потенциал дисплазии с последующей злокачественной трансформацией и обеспечивают до 30% всех колоректальных раков (КРР) [1, 3, 52]. Данный обзор посвящен выбору метода удаления зубчатых образований толстой кишки.

Полный текст статьи:
Текущая таксономия зубчатых полипов. Всемирная организация здравоохранения (ВОЗ) делит зубчатые образования на три отдельных подтипа: гиперпластические полипы (НР), зубчатые аденомы/полипы на широком основании (SSA/P) и традиционные зубчатые аденомы (TSA) [6]. Из них истинные НР как наиболее распространенные, так и наиболее доброкачественные. По количеству содержания муцина НР подразделяются на микровезикулярные (MVSP), богатые бокаловидными клетками (goblet cell-rich serrated polyp, GCSP) и бедные муцином (mucin-poor serrated polyp, MPSP). Прогностическая значимость отдельных подтипов НР не определена, поэтому патоморфологи обычно не используют эту номенклатуру в клинической практике [9].
SSA/P – наиболее распространенные зубчатые образования, обладающие злокачественным потенциалом. Гистологически SSA/P характеризуются особой формой основания крипт в виде перевернутой буквы Т (якорь) или буквы L (сапог) [10, 55]. В отличие от НР, SSA/P, как правило, больше 5 мм, расположены проксимальнее селезеночного изгиба и имеют нерегулярные границы [11].
TSA — относительно редкие предраковые зубчатые образования. В отличие от SSA/P, TSA имеют более полиповидный макротип [12]. Гистологически они характеризуются наличием эктопических крипт, которые разветвляются под тупыми углами. В большинстве случаев TSA имеют ворсинчатое строение, часто с отечными, булавовидно расширенными на концах ворсинами — bulbous tips. Другим важным диагностическим критерием являются эозинофильные изменения — столбчатые клетки с эозинофильной цитоплазмой и центрально расположенным вытянутым ядром. Независимо от описанных эозинофильных изменений в TSA могут присутствовать очаги традиционной дисплазии разной степени тяжести [8, 13]. Образования с признаками как зубчатых, так и традиционных аденом особенно трудны для диагностики. Также может существовать гибридная форма тубулопапиллярной аденомы с зубчатыми признаками [56].
Неоднозначно отношение к термину «смешанный полип». Этот термин обычно при- меняется к образованиям с признаками как SSA/P, TSA или HP, так и обычной аденомы. В настоящее время признано, что многие образования, ранее обозначенные смешанными полипами, были, вероятно, SSA/P с цитологической дисплазией [8, 55]. Одна- ко Британское общество гастроэнтерологии предлагает сохранить этот термин для сложных случаев [14].
Диагностика зубчатых образований толстой кишки. Своевременная диагностика зубчатых образований толстой и прямой кишки и выбор правильной тактики в последние годы считается чрезвычайно важной задачей – главным образом из-за гистологической гетерогенности и специфических клинических и молекулярных паттернов образований [15]. Зубчатые образования чрезвычайно часто становятся причиной интервальных раков, особенно правосторонней локализации, и было доказано, что более высокие показатели их обнаружения — мера профилактики интервальных КРР [16].
Любое качество подготовки кишечника ниже высокого связано со значительным снижением частоты обнаружения SSA/P. Несмотря на то, что удовлетворительная подготовка (BBPS 2-2-2) достаточна для обнаружения обычных аденом, эти уровни неадекватны для обнаружения SSA/P [17]. Одноэтапная схема подготовки накануне вечером использоваться не должна [18]! Было проведено исследование, посвященное частоте выявления именно SSA/P при подготовке полнообъемным полиэтиленгликолем и малообъемным полиэтиленгликолем с аскорбатным комплексом (МОВИПРЕП®), подготовка во всех случаях проводилась в разделенной дозе. При равной частоте адекватной подготовки выявление SSA/P было достоверно выше в группе пациентов, принимавших МОВИПРЕП® (11,9% против 7,9%, Р = 0,005) [18].
Полиэтиленгликоль с аскорбатным комплексом (МОВИПРЕП®) лучше переносится, вызывая достоверно меньше нежелательных явлений в виде тошноты и рвоты. Применение сплит-дозы малообъемного препарата ПЭГ с аскорбатным комплексом (МОВИПРЕП®) — эффективный, безопасный и комфортный метод подготовки толстой кишки к колоноскопии. Отмечено, что большая доля пациентов оценила МОВИПРЕП® как более удобный по сравнению со стандартным полиэтиленгликолем объемом 4 л, а также большая доля пациентов готова принимать повторно МОВИПРЕП®, а не препарат на основе ПЭГ объемом 4 л [20, 21, 22, 23].
Также на частоту выявления SSA/P влияет время выведения колоноскопа. Каждая дополнительная минута свыше 6 минут увеличивает вероятность обнаружения данного типа образований, оптимально время выведения не менее 9 минут [1, 14, 25].
Осмотр восходящей кишки в ретрофлексии также повышает частоту выявления SSA/P [1, 14, 24].
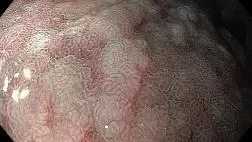
Гиперпластические полипы (HP). НР — наиболее распространенные зубчатые неоплазии. 25% лиц среднего возраста имеют хотя бы один колоректальный НР [14]. В целом считается, что НР не обладают злокачественным потенциалом, особенно если они малы (<5 мм) и расположены в дистальных отделах толстой кишки [3, 52]. Макроскопически HP представлены плоскими или сидячими диминутивными образованиями (<5 мм) бледно-розового цвета со звездчатым ямочным рисунком (II тип по классификации Kudo, рис. 1, 2) [15, 52].
В то же время Американское общество гастроинтестинальной эндоскопии (ASGE) особо подчеркивает, что оценка гистологии обнаруженных при колоноскопии диминутивных (5 мм) колоректальных полипов in vivo в реальном времени может быть достигнута только с помощью оптической биопсии NBI, только эндоскопистами, которые являются экспертами в использовании этой передовой технологии визуализации, — и только когда оценки сделаны с высокой уверенностью [28].
Для удаления диминутивных полипов толстой кишки ESGE рекомендует метод холодной петлевой полипэктомии, позволяющий провести полную резекцию и получить достаточный материал для эндоскопического исследования, кроме того, данный метод имеет низкую частоту осложнений (высокое качество доказательств, сильная рекомендация) [29].
Зубчатые аденомы на широком основании (SSA/P). На долю SSA/P приходится 2–5% всех колоректальных полипов и 15–25% всех зубчатых образований толстой кишки [8]. SSA/P были обнаружены в 9% скрининговых колоноскопий [54]. Определены факторы риска развития SSA/P — это табакокурение, алкоголизм и ожирение [1, 8]. Чаще всего (до 75%) SSA/P локализованы проксимальнее селезеночного изгиба ободочной кишки, имеют плоский или плоско-приподнятый макроскопический тип (0-IIb или 0-IIa по Парижской классификации), с нечеткими краями, размерами более 5 мм. Часто имеют вид складки слизистой бледно-розового цвета при осмотре в белом свете, почти неотличимы от окружающей слизистой (рис. 3). Около двух третей SSA/P покрыты плотной шапочкой слизи, также эти образования могут быть окружены так называемым ободком мусора — скоплением плотных частиц содержимого толстой кишки по контуру образования. Надо учесть, что после отмывания поверхности SSA/P их визуализация при стандартном осмотре в белом свете ухудшается. При дальнейшем накоплении аберрантного метилирования ДНК в SSA/P происходят диспластические изменения. Макроскопически это проявляется изменениями, напоминающими обычную аденому (рис. 4) [1].
Основной принцип лечения SSA/P — полное их удаление. Все зубчатые образования, за исключением диминутивных полипов ректосигмоидного отдела и прямой кишки, должны быть извлечены. Однако эндоскопическое выявление и резекция SSA/P затруднительны ввиду плоского макротипа, трудноразличимой поверхности и нечетких границ. После обнаружения эти образования могут быть удалены эндоскопически с использованием принципов резекции обычных аденом (табл. 1 на с. 12) [1, 29].
Удаление небольших SSA/P (до 10 мм). Идеальный метод удаления диминутивных и малых (до 10 мм) SSA/P — правильно выполненная холодная петлевая полипэктомия, характеризующаяся высокой эффективностью и безопасностью [31, 32]. Холодная петлевая полипэктомия превосходит по полноте резекции щипцовую полипэктомию [32, 33].
Горячая петлевая полипэктомия сопряжена с высокими показателями глубокого повреждения тканей, неадекватными гистологическими образцами, неполной резекцией и в настоящее время сильно дискредитирована [34, 35, 37].
Именно холодная петлевая полипэктомия обеспечивает полное удаление образования, которое достигается при захвате 1–2 мм нормальной слизистой [36, 37]. Риск осложнений, связанных с холодной петлевой полипэктомией, таких как перфорация и клинически значимые кровотечения, крайне низок [31]. Частота перфорации незначительна, так как петля не способна про- резать muscularis propria. Чаще перфорация связана с классической петлевой электроэксцизией [40, 41].
1. Расположите образование в положении с 5 до 6 часов.
2. Поместите катетер открытой петли на нормальную слизистую на 1–2 мм дистальнее поражения с кончиком петли на 1–2 мм проксимальнее поражения. Жесткие тонко-проволочные петли более эффективны.
3. Закрепите катетер на месте на слизистой оболочке путем нисходящей ангуляции дистального конца эндоскопа (вращая большой винт от себя).
4. Закройте петлю, захватив образование с запасом нормальной ткани. Избегайте чрезмерного раздувания просвета кишки, чтобы петля не соскользнула. Если это произошло, осторожно аспирируйте газ во время закрытия петли.
5. Небольшие плоские неполиповидные образования (0-IIa и 0-Iib по Парижской классификации) могут быть трудны для захвата. Метод всасывания псевдополипа, при котором опухоль втягивается в аспирационный канал колоноскопа и непрерывно всасывается в течение 5 секунд, пока колоноскоп мягко выводится, позволяет сформировать псевдополип для облегчения последующей резекции. Было показано, что это безопасный, эффективный и воспроизводимый прием для удаления образований такого типа [38, 39].
6. Расширить дефект слизистой после полипэктомии с помощью струи воды. Это расширяет дефект и его края, облегчая осмотр остаточной ткани полипа.
Удаление крупных SSA/P (10–20 мм). Метод первой линии для удаления латерально растущих опухолей — эндоскопическая резекция слизистой (EMR — endoscopic mucosal resection, рис. 5). Хотя доказательная база по большей части основана на резекции стандартных аденом [37, 42, 44, 45], некоторые исследования показали, что большие (10 мм) SSA/P также могут быть адекватно удалены при помощи этого метода [45].
Средний размер больших SSA/P, как правило, меньше, чем у стандартных латерально растущих аденом. Более того, SSA/P обычно не имеют фиброза в подслизистом слое и более свободно приподнимаются при проведении гидролифтинга — их легче удалить данным методом [46]. В то же время стандартная EMR с применением диатермокоагуляции ассоциирована с такими осложнениями, как перфорация (1–2%), постполипэктомический синдром (0,5%) и клинически значимые кровотечения (6–11%) [42, 47]. Поэтому на сегодняшний день для удаления больших (от 10 мм в диаметре) SSA/P активно внедряется EMR холодной петлей, в том числе методом кускования. Применение данного способа позволяет избежать серьезных осложнений, связанных со стандартной методикой. Рецидивы в результате неполного удаления, частота которых составляет 6,3–8,7%, удается успешно излечить эндоскопически. В последних публикациях предполагается, что резекция слизистой холодной петлей в отношении недиспластических SSA/P может стать стандартной методикой [15, 45, 48, 49, 50].
Удаление крупных SSA/P (>20 мм). Безопасный и эффективный метод лечения SSA/P >20 мм — рEMR (piecemeal endoscopic mucosal resection, рис. 6), при этом частота рецидивов сопоставима с таковой при стандартных аденомах аналогичного размера (8,7% против 11,1%, Р = 0,8) [58]. рEMR позволяет успешно удалить SSA/P почти во всех случаях. Проспективное исследование австралийских ученых, проанализировавших результаты лечения в общей сложности 2000 неоплазий (323 SSA/P у 246 пациентов и 1527 стандартных аденом у 1425 пациентов) показало, что риск рецидива после рEMR для SSA/P >20 мм ниже, чем для традиционных аденом, хотя и не пренебрежимо мал (6,3% против 16% через 6 месяцев,
7% против 20% через 12 месяцев). Количество кровотечений во время резекции для SSA/P ниже, чем для стандартных аденом [46]. Следует учитывать тот факт, что злокачественный потенциал SSA/P ограничен и не уравновешивает риски осложнений и технические сложности диссекции в подслизистом слое [15, 51].
Технические рекомендации по удалению крупных SSA/P методом pEMR [1]:
1. Внимательно осмотрите очаг поражения для определения границ образования и признаков дисплазии. Для этого будет полезным использовать уточняющие методики (эндоскопия высокого разрешения, хромоскопия или узкоспектральные режимы). Использование подкрашенного раствора для гидролифтинга также позволит лучше визуализировать границы образования.
2. Убедитесь, что петля захватывает 1–2 мм нормальной слизистой вокруг полипа. Используйте pEMR вместо горячей полипэктомии для SSA/P от 10 до 20 мм, так как этот метод имеет более высокие показатели полной резекции. Фрагментарная холодная полипэктомия — альтернативная методика.
3. Прочно закрепите катетер петли на нормальной ткани на 1–2 мм от края образования и позвольте полипу войти в открытую петлю путем откачивания воздуха из просвета. При дальнейшей десуффляции затяните петлю, чтобы захватить образование, но не закрывайте полностью.
4. В этот момент авторы предпочитают за- брать рукоятку петли у ассистента и закрывать ее самостоятельно в пределах 1 см. Нужно оценить подвижность захваченной ткани относительно стенки кишки с по- следующей резекцией диатермокоагулятором (EndoCut Q, effect 3, cut duration 1, cut interval 6; VIO 300D; Erbe).
5. Тщательно оцените края резекции на предмет резидуальной опухолевой ткани.
6. Риск рецидива после pEMR может быть уменьшен путем абляции краев резекции в режиме коагуляции (soft coagulation effect 4, 80W) методом касания.
7. В случае недостаточного опыта проведения pEMR рекомендуется направить пациента в экспертный центр.
TSA выявляются преимущественно в дистальной части толстой и прямой кишки, хотя могут быть расположены в любом отделе. В большинстве случаев они имеют вид полиповидного образования на ножке (0-Ip) или на широком основании (0-Is), но встречаются неполиповидные плоско-приподнятые образования (0-IIa). Полиповидные формы более характерны для дистальной части толстой кишки, а неполиповидные — для проксимальной (рис. 7) [13].
Вывод:
Согласно классификации ВОЗ, зубчатые образования толстой кишки разделены на три подтипа: гиперпластические полипы, зубчатые аденомы/полипы на широком основании и традиционные зубчатые аденомы. Из них зубчатые аденомы/полипы на широком основании и традиционные зубчатые аденомы являются предраками. Зубчатые аденомы/полипы на широком основании — основная причина интервальных раков, так как крайне сложны для визуализации благодаря своим макроскопическим особенностям: плоскому макротипу, бледной поверхности и нечетким краям. Для выявления этих образований необходимо качество подготовки толстой кишки не ниже отличного. Наилучшие результаты в частоте выявления зубчатых аденом/полипов на широком основании достигаются при применении подготовки полиэтиленгликолем с аскорбатным комплексом (МОВИПРЕП®) в разделенной дозе.
Истинные гиперпластические полипы не имеют злокачественного потенциала, но при этом есть существенные трудности в дифференциальной диагностике между ними и зубчатыми аденомами на широком основании. В рутинной практике на основании макроскопической картины достоверно дифференцировать гиперпластические полипы крайне сложно, поэтому все образования толстой кишки должны быть удалены. Для удаления зубчатых образований толстой кишки используются стандартные тактические подходы. Однако показания к холодной петлевой полипэктомии/резекции слизистой и резекции слизистой методом кускования в отношении зубчатых аденом/полипов на широком основании должны быть расширены.
Список литературы:
2. Bosman F.T., Carneiro F., Hruban R.H., Theise N.D. WHO classification of tumours of the digestive system. Lyon: IARC Press. 2010.
3. Rex D.K., Ahnen D.J., Baron J.A., et al. Serrated lesions of the colorectum: review and recommendations from an expert panel. Am J Gastroenterol. 2012. 107: 1315–1329. DOI: 10.1038/ajg.2012.161.
4. Yang H.M., Mitchell J.M., Sepulveda J.L., Sepulveda
A.R. Molecular and histologic considerations in the assessment of serrated polyps. Arch Pathol Lab Med. 2015. 139: 730–741. DOI: 10.5858/arpa.2014-0424- RA.
5. IJspeert JE, Vermeulen L, Meijer GA, Dekker E. Serrated neoplasia-role in colorectal carcinogenesis and clinical implications. Nat Rev Gastroenterol Hepatol. 2015;12:401–409. DOI: 10.1038/nrgastro.2015.73.
6. Obuch J.C., Pigott C.M., Ahnen D.J. Sessile serrated polyps: detection, eradication, and prevention of the evil twin. Curr Treat Options Gastroenterol. 2015. 13: 156–170. DOI: 10.1007/s11938-015-0046-y.
7. Crockett S.D., Snover D.C., Ahnen D.J., Baron J.A. Sessile serrated adenomas: an evidence-based guide to management. Clin Gastroenterol Hepatol. 2015. 13: 11–26. DOI: 10.1016/j.cgh.2013.10.035.
8. O’Connell B.M., Crockett S.D. The clinical impact of serrated colorectal polyps. Clin Epidemiol. 2017. Feb 22; 9: 113–25. eCollection 2017. PMID: 28260946. PMCID: PMC5327852. DOI: 10.2147/CLEP. S106257.
9. Torlakovic E., Skovlund E., Snover D.C., Torlakovic G., Nesland J.M. Morphologic reappraisal of serrated colorectal polyps. Am J Surg Pathol. 2003. 27: 65–81.
10. Lash R.H., Genta R.M., Schuler C.M. Sessile serrated adenomas: prevalence of dysplasia and carcinoma in 2139 patients. J Clin Pathol. 2010. 63: 681–6.
11. Lambert R., Kudo S.E, Vieth M., Allen J.I., Fujii H., Fujii T., et al. Pragmatic classification of superficial neoplastic colorectal lesions. Gastrointest Endosc. 2009. 70: 1182–1199.
12. Torlakovic E.E., Gomez J.D., Driman D.K., Parfitt J.R., Wang C., Benerjee T., et al. Sessile serrated adenoma (SSA) vs. traditional serrated adenoma (TSA). Am J Surg Pathol. 2008. 32: 21–29.
13. Saito S1, Tajiri H1, Ikegami M1. Serrated polyps of the colon and rectum: Endoscopic features including image enhanced endoscopy. World J Gastrointest Endosc. 2015. Jul 25. 7 (9):860–871. DOI: 10.4253/ wjge.v7.i9.860. PMID: 26240687.
14. East J.E., Atkin W.S., Bateman A.C., Clark S.K., Dolwani S., Ket S.N., Leedham S.J., Phull P.S., Rutter M.D., Shepherd N.A., Tomlinson I., Rees C.J. British Society of Gastroenterology position statement on serrated polyps in the colon and rectum. Gut. 2017. Jul; 66 (7): 1181–1196. Epub 2017 Apr 27. PMID: 28450390 PMCID: PMC5530473 DOI: 10.1136/ gutjnl-2017-314005.
15. Cassese G., Amendola A., Maione F., Giglio M.C., Pagano G., Milone M., Aprea G., Luglio G., De Palma
G.D. Serrated Lesions of the Colon-Rectum: A Focus on New Diagnostic Tools and Current Management. Gastroenterol Res Pract. 2019. Jan 10; 2019: 9179718. DOI: 10.1155/2019/9179.
16. Baxter N.N., Sutradhar R., Forbes S.S., et al. Analysis of administrative data finds endoscopist quality measures associated with postcolonoscopy colorectal cancer. Gastroenterology. 2011. 140: 65–72. DOI: 10.1053/j. gastro.2010.09.006.
17. Clark B.T., Laine L. High-quality bowel preparation is required for detection of sessile serrated polyps. Clin Gastroenterol Hepatol. 2016. 14: 1155–1162. DOI: 10.1016/j.cgh.2016.03.044.
18. Hassan C, Bretthauer M., Kaminski M.F., Polkowski M., Rembacken B., Saunders B., Benamouzig R., Holme O., Green S., Kuiper T., Marmo R., Omar M., Petruzziello L., Spada C., Zullo A., Dumonceau J.M.; European Society of Gastrointestinal Endoscopy. Bowel preparation for colonoscopy: European Society of Gastrointestinal Endoscopy (ESGE) guideline. Endoscopy. 2013. 45 (2):142–150. Epub 2013 Jan 18. PMID: 23335011 DOI: 10.1055/s-0032-1326186.
19. Siddiki H., Ravi S., Al-Qaisi M.T., Fath A.R., Ramirez F., Crowell M.D., Pannala R., Faigel D.O., Gurudu S.R. Comparison versus large volume for colonoscopy: A Study Outcomes. Dig Dis Sci. 2018. May 7. DOI: 10.1007/s10620-018-5102-8 [Epub ahead of print]. PMID: 29736830.
20. Kojecky V, Dastych M, Zadorova Z, Varga M, Hajer J, Kment M, Kroupa R, Kunovska M, Matous J, Misurec M, Hep A, Kianicka B, Latta J. [Effective bowel preparation before coloscopy — low-volume PEG in the divided dose regimen]. Vnitr Lek. 2016. Apr 62 (4): 249–254. PMID: 27250601.
21. Xie Q., Chen L., Zhao F., Zhou X., Huang P., et al. (2014) A meta-analysis of randomized controlled trials of low-volume polyethylene glycol plus ascorbic acid versus standard-volume polyethylene glycol solution as bowel preparations for colonoscopy. PLoS One.9 (6): e99092. DOI:10.1371/journal.pone.0099092.
22. Ponchon T. et al. A low-volume polyethylene glycol plus ascorbate solution for bowel cleansing prior to colonoscopy: the NORMO randomised clinical trial. Digestive and Liver Disease. 2013. Oct; 45 (10): 820– 826. DOI: 10.1016/j.dld.2013.04.009. Epub 2013 Jun 14.
24. Chandran S., Parker F., Vaughan R., et al. Right- sided adenoma detection with retroflexion versus forward-view colonoscopy. Gastrointest Endosc. 2015. 81: 608–613. DOI: 10.1016/j.gie.2014.08.039.
25. Butterly L., Robinson C.M., Anderson J.C., et al. Serrated and adenomatous polyp detection increases with longer withdrawal time: results from the New Hampshire Colonoscopy Registry. Am J Gastroenterol. 2014. 109: 417–426. DOI: 10.1038/ajg.2013.442.
26. Fidalgo C., Santos L., Rosa I., Fonseca R., Lage P., Claro I., Chaves P., Dias Pereira A. Hyperplastic polyp? Look again… The impact of the new classification for serrated polyps. Acta Med Port. 2014. May-Jun; 27 (3): 304–308. Epub 2014 Jun 30. PMID: 25017341.
27. Schachschal G., Sehner S., Choschzick M., Aust D., Brandl L., Vieth M., et al. Impact of reassessment of colonic hyperplastic polyps by expert GI pathologists. Int J Colorectal Dis. 2016. 31: 675–683.
28. ASGE Technology Committee, Abu Dayyeh B.K., Thosani N., Konda V., Wallace M.B., Rex D.K., Chauhan S.S., Hwang J.H., Komanduri S., Manfredi M., Maple J.T., Murad F.M., Siddiqui U.D., Banerjee
S. ASGE Technology Committee systematic review and meta-analysis assessing the ASGE PIVI thresholds for adopting real-time endoscopic assessment of the histology of diminutive colorectal polyps. Gastrointest Endosc. 2015. Mar; 81 (3): 502.e1–502.e16. Epub 2015 Jan 16. PMID: 25597420. DOI: 10.1016/j. gie.2014.12.022.
29. Ferlitsch M., Moss A., Hassan C., Bhandari P., Dumonceau J.M., Paspatis G., Jover R., Langner C., Bronzwaer M., Nalankilli K., Fockens P., Hazzan R., Gralnek I.M., Gschwantler M., Waldmann E., Jeschek P., Penz D., Heresbach D., Moons L., Lemmers A., Paraskeva K., Pohl J., Ponchon T., Regula J., Repici A., Rutter M.D., Burgess N.G., Bourke M.J. Colorectal polypectomy and endoscopic mucosal resection (EMR): European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy. 2017. Mar; 49 (3): 270–297. DOI: 10.1055/s-0043-102569. Epub 2017 Feb 17.
30. Murakami T., Sakamoto N., Nagahara A. Endoscopic diagnosis of sessile serrated adenoma/polyp with and without dysplasia/carcinoma. World J Gastroenterol. 2018. Aug 7; 24 (29): 3250–3259. Published online 2018 Aug 7. DOI: 10.3748/wjg.v24.i29.3250. PMCID: PMC6079289.
31. Repici A., Hassan C., Vitetta E., et al. Safety of cold polypectomy for <10 mm polyps at colonoscopy: a prospective multicenter study. Endoscopy. 2012. 44: 27–31. DOI: 10.1055/s-0031-1291387.
32. Lee C.K., Shim J.J., Jang J.Y. Cold snare polypectomy vs. cold forceps polypectomy using double-biopsy technique for removal of diminutive colorectal polyps: a prospective randomized study. Am J Gastroenterol. 2013. 108: 1593–1600. DOI: 10.1038/ajg.2013.302.
33. Raad D., Tripathi P., Cooper G., Falck-Ytter Y. Role of the cold biopsy technique in diminutive and small colonic polyp removal: a systematic review and meta- analysis. Gastrointest Endosc. 2016. 83: 508–515. DOI: 10.1016/j.gie.2015.10.038.
34. Metz A.J., Moss A., McLeod D., et al. A blinded comparison of the safety and efficacy of hot biopsy forceps electrocauterization and conventional snare polypectomy for diminutive colonic polypectomy in a porcine model. Gastrointest Endosc. 2013. 77: 484–490. DOI: 10.1016/j.gie.2012.09.014.
35. Kim J.S., Lee B.I., Choi H., et al. Cold snare polypectomy versus cold forceps polypectomy for diminutive and small colorectal polyps: a randomized controlled trial. Gastrointest Endosc. 2015. 81: 741–747. DOI: 10.1016/j.gie.2014.11.048.
36. Hewett D.G. Cold snare polypectomy: optimizing technique and technology (with videos) Gastrointest Endosc. 2015. 82: 693–696. DOI: 10.1016/j. gie.2015.04.028.
37. Burgess N.G., Bahin F.F., Bourke M.J. Colonic polypectomy (with videos) Gastrointest Endosc. 2015. 81: 813–835. DOI: 10.1016/j.gie.2014.12.027.
38. Pattullo V., Bourke M.J., Tran K.L., et al. The suction pseudopolyp technique: a novel method for the removal of small flat nonpolypoid lesions of the colon and rectum. Endoscopy. 2009. 41: 1032–1037. DOI: 10.1055/s-0029-1215294.
39. Din S., Ball A.J., Riley S.A., Kitsanta P., Johal S. A randomized comparison of cold snare polypectomy versus a suction pseudopolyp technique. Endoscopy. 2015. 47: 1005–1010. DOI: 10.1055/s-0034-1392533.
40. Chukmaitov A., Bradley C.J., Dahman B., Siangphoe U., BouHaidar D., Warren J.L. Polypectomy techniques, endoscopist characteristics, and serious gastrointestinal adverse events. J Surg Oncol. 2014. 110: 207–213. DOI: 10.1002/jso.23615.
41. Ko C.W., Riffle S., Michaels L., et al. Serious complications within 30 days of screening and surveillance colonoscopy are uncommon. Clin Gastroenterol Hepatol. 2010. 8: 166–173. DOI: 10.1016/j.cgh.2009.10.007.
42. Moss A., Bourke M.J., Williams S.J., et al. Endoscopic mucosal resection outcomes and prediction of submucosal cancer from advanced colonic mucosal neoplasia. Gastroenterology. 2011. 140: 1909–1918. DOI: 10.1053/j.gastro.2011.02.062.
43. Ferrara F., Luigiano C., Ghersi S., et al. Efficacy, safety and outcomes of ‘inject and cut’ endoscopic mucosal resection for large sessile and flat colorectal polyps. Digestion. 2010. 82: 213–220. DOI: 10.1159/000284397.
45. Tutticci N.J., Hewett D.G. Cold EMR of large sessile serrated polyps at colonoscopy (with video). Gastrointest Endosc. 2018. Mar 87 (3): 837–842. Epub 2017 Nov 10. PMID: 29133196. DOI: 10.1016/j.gie.2017.11.002.
46. Pellise M., Burgess N.G., Tutticci N., et al. Endoscopic mucosal resection for large serrated lesions in comparison with adenomas: a prospective multicentre study of 2000 lesions. Gut. 2017. 66: 644–653. DOI: 10.1136/gutjnl-2015-310249.
47. Cha J.M., Lim K.S., Lee S.H., et al. Clinical outcomes and risk factors of post-polypectomy coagulation syndrome: a multicenter, retrospective, case-control study. Endoscopy. 2013. 45: 202–207. DOI: 10.1055/s-0032-1326104.
48. Choksi N., Elmunzer B.J., Stidham R.W., Shuster D., Piraka C. Cold snare piecemeal resection of colonic and duodenal polyps ≥1 cm. Endosc Int Open. 2015. 3: E508–E513. DOI: 10.1055/s-0034-1392214.
49. Muniraj T., Sahakian A., Ciarleglio M.M., Deng Y., Aslanian H.R. Cold snare polypectomy for large sessile colonic polyps: a single-center experience. Gastroenterol Res Pract. 2015. 2015: 175959. DOI: 10.1155/2015/175959.
50. Tate D.J., Awadie H., Bahin F.F., Desomer L., Lee R., Heitman S.J., Goodrick K., Bourke M.J. Wide- field piecemeal cold snare polypectomy of large sessile serrated polyps without a submucosal injection is safe. Endoscopy. 2018. Mar; 50 (3): 248–252. DOI: 10.1055/ s-0043-121219. Epub 2017 Nov 23. PMID: 29169195 DOI: 10.1055/s-0043-121219.
51. Mizushima T., Kato M., Iwanaga I., et al. Technical difficulty according to location, and risk factors for perforation, in endoscopic submucosal dissection of colorectal tumors. Surgical Endoscopy. 2015. 29 (1): 133–139. DOI: 10.1007/s00464-014-3665-9.
52. O’Connell B, Hafiz N, Crockett S. The Serrated Polyp Pathway: Is It Time to Alter Surveillance Guidelines? Curr Gastroenterol Rep. 2017. Aug 29; 19 (10): 52. PMID: 28853002. PMCID: PMC5642051. DOI: 10.1007/s11894-017-0588-3.
53. Rastogi A. Optical Diagnosis of Small Colorectal Polyp Histology with High-Definition Colonoscopy Using Narrow Band Imaging Clin Endosc. 2013. Mar; 46 (2): 120–129. Published online 2013 Mar 31. DOI: 10.5946/ce.2013.46.2.120. PMCID: PMC3630305. PMID: 23614121.
54. Spring K.J., Zhao Z.Z., Karamatic R., Walsh M.D., Whitehall V.L., Pike T. et al. High prevalence of sessile serrated adenomas with BRAF mutations: a prospective study of patients undergoing colonoscopy. Gastroenterology. 2006. 131 (5): 1400–1407.
55. Snover D.C. Update on the serrated pathway to colorectal carcinoma. Hum Pathol. 2011. 42: 1–10.
56. Bettington M., Walker N., Rosty C., Brown I., Clouston A., McKeone D., et al. Serrated tubulovillous adenoma of the large intestine. Histopathology. 2016. 68: 578–587.
57. Niv Y. Changing pathological diagnosis from hyperplastic polyp to sessile serrated adenoma: systematic review and meta-analysis. Eur J Gastroenterol Hepatol. 2017. Dec; 29 (12): 1327–1331. PMID: 29049128 DOI: 10.1097/MEG.0000000000000994.
58. Rex K.D., Vemulapalli K.C., Rex D.K. Recurrence rates after EMR of large sessile serrated polyps. Gastrointest Endosc. 2015. 82: 538–541. DOI: 10.1016/j.gie.2015.01.025.
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.















.jpg)




.png)














Комментарии