- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: ВИЗУАЛЬНАЯ ДИАГНОСТИКА ЗУБЧАТЫХ ОБРАЗОВАНИЙ ТОЛСТОЙ КИШКИ
| Авторы: | Аникина М.С. 1 2019г. |
| Об авторах: |
1. ГБУЗ НСО «Государственная Новосибирская областная клиническая больница» |
Аннотация:
По зубчатому пути развивается 15–30% спорадических колоректальных раков. Своевременное выявление зубчатых образований — актуальная задача современной эндоскопии. В обзоре рассмотрены вопросы зубчатого пути канцерогенеза и дифференциальной диагностики зубчатых неоплазий толстой кишки.
Полный текст статьи:
Введение. С 2010 года зубчатые образования включены в группу предопухолевых заболеваний толстой кишки и разделены на три основные категории: гиперпластические полипы (HP), зубчатые аденомы (синоним — полипы) на широком основании (SSA/P) и традиционные зубчатые аденомы (TSA) [1, 4, 6]. По крайней мере треть взрослых людей имеют зубчатые неоплазии толстой и прямой кишки, а 70–90% всех зубчатых неоплазий — это HP. Распространенность зубчатых аденом составляет от 2 до 20%. Такой большой разброс данных связан с существенными различиями в частоте обнаружения полипов среди практикующих эндоскопистов и с непоследовательной патоморфологической интерпретацией этих поражений [15]. До настоящего времени считается, что HP не обладают злокачественным потенциалом, однако SSA/P и TSA способны трансформироваться в рак по так называемому зубчатому пути канцерогенеза, на долю которого приходится 15–30% всех колоректальных раков (КРР) [1, 4, 6].
Зубчатый путь канцерогенеза
Классическая концепция развития спорадического КРР основана на возникновении его из обычных аденом через путь-супрессор, начинающийся с мутации гена APC (модель Fearon-Vogelstein), на долю которого приходится 60% всех КРР [1]. Зубчатый путь имеет два возможных направления молекулярного патогенеза. Более распространенный из них инициируется мутацией в протоонкогене BRAF и через механизм аберрантного метилирования гена, известного как метиляторный фенотип (CIMP — CpG island methylator phenotiр), что функционально эквивалентно инактивирующей мутации. Инактивация гена репарации ДНК MLH1 приводит к КРР с высокой микросателлитной нестабильностью (MSI-H), на долю которого приходится до 15% спорадического КРР. Это зубчатый путь канцерогенеза, предшественником КРР в котором считается сидячая зубчатая аденома (SSA/Р) — уникальная неоплазия, имеющая архитектурную дисплазию, но цитологическую дисплазию лишь в редких случаях [3, 7, 10]. Следует отметить, что при аберрантном метилировании промоторных участков гена-онкосупрессора MGMT возможно развитие спорадического микросателлитно-стабильного (MSS) КРР из SSA/Р, который составляет 6–8% всех КРР [3, 6].
Менее изученный и более редкий молекулярный патогенез включает мутацию в гене KRAS и через хромосомную нестабильность приводит к спорадическому MSS КРР. Считается, что данный путь обусловливает до 5% всех спорадических КРР, которые возникают из традиционной зубчатой аденомы (TSA) [6, 7, 10]. При этом TSA генетически и фенотипически более гетерогенны, чем SSA/Р. TSA могут иметь мутации в гене BRAF и идти по зубчатому пути, приводя к КРР с MSI (рис. 1).
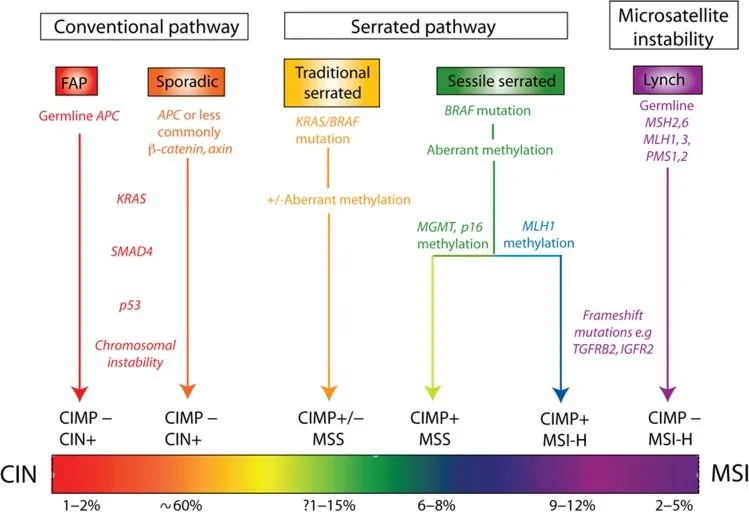
Рисунок 1. Патогенез КРР [6].
Гиперпластические полипы (НР)
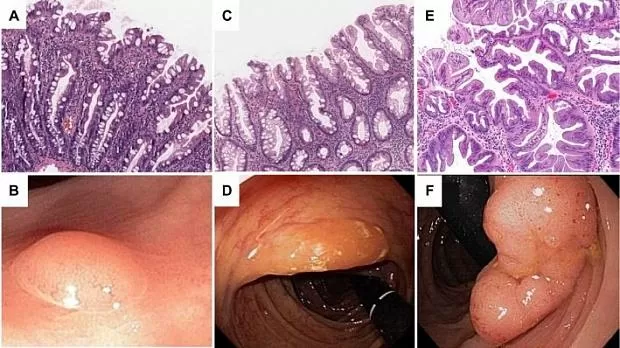
Это наиболее распространенные зубчатые неоплазии. 25% лиц среднего возраста имеют хотя бы один колоректальный НР. Чаще всего НР локализованы в левой половине толстой и в прямой кишке (75–80%). Макроскопически НР представлены плоскими или сидячими диминутивными образованиями (<5 мм) бледно-розового цвета, со звездчатым ямочным рисунком (II тип по классификации Kudo) (рис. 7 — А, В) [6].
Микроскопическая картина. При морфологическом исследовании НР определяется зубчатость в верхней части крипт до верхней трети крипт в большинстве случаев, зубчатый или звездчатый формы просвет. Важно отметить, что нижняя часть крипты остается узкой, прямой, трубчатой (тубулярной) без горизонтального или нерегулярного ветвления, без появления дилатации. Пролиферативная зона занимает базальную треть нижней части крипты, и зона является симметричной, в глубине крипт часто визуализируется расширение пролиферативной зоны. В верхней части крипт стратификации не наблюдается, то есть отсутствуют как структурные, так и клеточные признаки неоплазии. Минимальная цитологическая атипия присутствует, ядерной атипии нет, за исключением некоторых везикулярных ядер. Оценка архитектуры наиболее важна, поскольку атипию можно увидеть в воспаленных полипах с регенераторными изменениями. Большие НР встречаются редко, их строение отличается усиленной зубчатостью и дилатацией просвета крипт. В них нормальная пролиферация. Значительный риск злокачественного развития в НР повышен при наличии синхронных аденом или SSA.
Гистологически выделяют три подтипа НР:
• микровезикулярный (microvesicular serrated polyps, MVSPs);
• богатый бокаловидными клетками (goblet cell-rich serrated polyps, GCSPs);
• бедный муцином (mucin-poor serrated polyps, MPSPs) — редко встречающийся.
Степень зубчатости просвета может варьировать между этими подтипами. Различать их не имеет клинического и прогностического значения для пациентов, однако эти подклассификации были использованы в научных исследованиях [1, 4, 10].
При этом существуют сложности при дифференциальной диагностике НР и SSA/Р. Метаанализ, включивший восемь исследований (2625 пациентов) [14], выявил, что коэффициент соотношения количества НР с измененным патологическим диагнозом от НР на SSA/Р составил 0,112 с 95-процентным доверительным интервалом (CI): 0,099–0,12 (P < 0,0001), или 11,2%. Неоднородность исследований была значительной при Q = 199.4, d.f. Q = 9, P < 0,0001 и I = 95,486%. Отношение шансов для изменения патоморфологического диагноза с HP на SSA/Р выше для образований, локализованных в правых отделах толстой кишки, и образований размерами более 5 мм (4.401, 95% CI: 2,784–6,958, P < 0,0001 и 8,336, 95% CI: 4,963–15,571, P <0,0001, соответственно). Для образований >5 мм морфологическое заключение НР может быть ошибочным [7, 14].
Зубчатые аденомы на широком основании (SSA/P)
На долю SSA/P приходится 2–5% всех колоректальных полипов и 15–25% всех зубчатых образований толстой кишки [4, 16]. Данные образования были обнаружены в 9% скрининговых колоноскопий [22].
Определены факторы риска развития SSA/P. Это табакокурение, алкоголизм и ожирение [13, 16].
Чаще всего (до 75%) SSA/P локализованы проксимальнее селезеночного изгиба ободочной кишки, имеют плоский или плоско-приподнятый макроскопический тип (0-IIb или 0-IIa по Парижской классификации), с нечеткими краями, размерами более 5 мм. Часто имеют вид складки слизистой — бледно-розового цвета при осмотре в белом свете, почти неотличимой от окружающей слизистой (рис. 2). Около 2/3 SSA/P покрыты плотной шапочкой слизи, также эти образования могут быть окружены так называемым ободком мусора — скоплением плотных частиц содержимого толстой кишки по контуру образования (рис. 3 — A, B). Надо учесть, что после отмывания поверхности SSA/P их визуализация при стандартном осмотре в белом свете ухудшается, подобное образование может быть ошибочно принято за складку слизистой (рис. 3 — C).
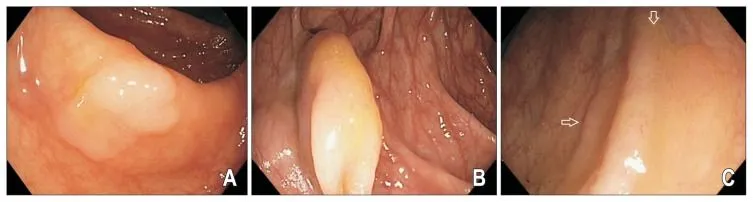
Рисунок 2. Эндоскопическая картина недиспластических SSA/P (указаны стрелками) [13].
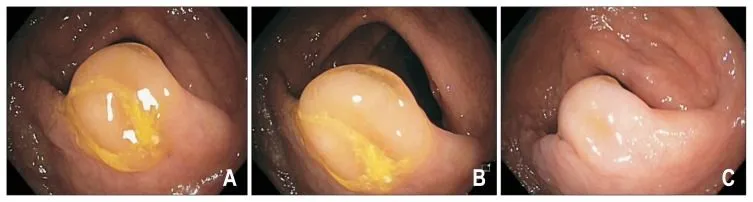
Рисунок 3. Эндоскопическая картина недиспластических SSA/P [13].
Обнаружение SSA/P требует хорошей подготовки кишечника и высокой клинической настороженности. Любое качество подготовки кишечника ниже высокого связано со значительным снижением частоты обнаружения SSA/Р. Несмотря на то, что удовлетворительная подготовка BBPS (2-2-2) достаточна для обнаружения обычных аденом, эти уровни неадекватны для обнаружения SSA/P [5]. Одноэтапная схема подготовки накануне вечером использоваться не должна [8]! Было проведено исследование, посвященное частоте выявления именно SSA/P при подготовке полнообъемным полиэтиленгликолем (ПЭГ) и малообъемным полиэтиленгликолем с аскорбатным комплексом (МОВИПРЕП®), подготовка во всех случаях проводилась в разделенной дозе. При равной частоте адекватной подготовки выявление SSA/P было достоверно выше в группе пациентов, принимавших МОВИПРЕП® (11,9 против 7,9%, Р = 0,005).
Полиэтиленгликоль с аскорбатным комплексом (МОВИПРЕП®) лучше переносится, вызывая достоверно меньше нежелательных явлений в виде тошноты и рвоты. Применение разделенной дозы малообъемного препарата ПЭГ с аскорбатным комплексом (МОВИПРЕП®) — эффективный, безопасный и комфортный метод подготовки толстой кишки к колоноскопии. Отмечено, что большая доля пациентов оценила МОВИПРЕП® как более удобный по сравнению со стандартным ПЭГ 4 л, а также большая доля пациентов готова принимать повторно МОВИПРЕП®, а не препарат на основе ПЭГ в объеме 4 л [12, 19, 20, 21].
Также на частоту выявления SSA/P влияет время выведения колоноскопа. Каждая дополнительная минута свыше 6 минут увеличивает вероятность обнаружения данного типа образований, оптимальным является время выведения не менее 9 минут. Осмотр восходящей кишки в ретрофлексии также повышает частоту выявления SSA/P [13].
Недиспластические SSA/P имеют однородный тип II-О ямочного рисунка. Тип II-Open выделен T. Kimura в 2012 году в дополнение к классификации S. Kudo (1996). Ямки при типе II-O шире и более округлые в сравнении с папиллярными и звездчатыми ямками при II типе по классификации Kudo. Чувствительность признака составляет 65,5%, а специфичность — 97,3% при условии использования увеличения и хромоскопии с индигокармином [2, 11, 13, 17]. При узкоспектральном осмотре (NBI) к предикторам SSA/P относятся поверхность в виде облака, нечеткие границы, нерегулярность рисунка и темные пятна внутри крипт. Осмотр в режиме NBI увеличивает качество дифференциальной диагностики диагностики SSA/P и неопухолевых изменений слизистой толстой кишки даже без использования увеличения (60%), использование режима NBI с увеличением повышает чувствительность метода до 80% [13, 17].
Дифференциальная диагностика аденоматозных неоплазий и недиспластических SSA/P, как правило, трудностей не вызывает [13, 17].
При дальнейшем накоплении аберрантного метилирования ДНК в SSA/P происходят диспластические изменения. Макроскопически это проявляется в появлении изменений, напоминающих обычную аденому (рис. 4) [13].
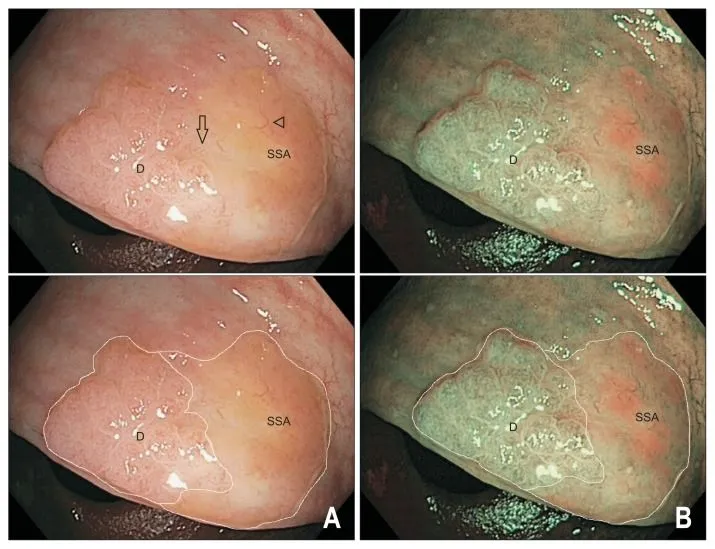
Рисунок 4. SSA с дисплазией [13].
20 мм SSA/P при осмотре в белом цвете (A) и в узкоспектральном режиме (B) с наличием участка дисплазии (метка D) и недиспластической зоны (метка SSA) в пределах одного образования. Участок дисплазии представлен плоско-приподнятым узловым компонентом на левой стороне образования с ямочным рисунком IV типа. Недиспластическая составляющая поражения (метка SSA) бледно-розового цвета с относительно гиповаскулярной поверхностью покрыта тонким слоем слизи (указано стрелками). Обратите внимание на отчетливую зону перехода от недиспластической плоской SSA/P к области дисплазии (указано стрелкой). Образование было удалено методом эндоскопической резекции слизистой единым блоком, гистологическое исследование подтвердило наличие дисплазии легкой степени.
Таким образом, обнаружение видимой точки перехода между двумя различными рисунками поверхности должно насторожить в отношении наличия дисплазии в образовании. Диспластический компонент обычно представляет собой небольшой (1–5 мм) центральный или периферийно расположенный узелок, а иногда минимально приподнятую или углубленную область в пределах поражения. Исследование ямочного рисунка в белом свете или узкоспектральном режиме выявляет два различных паттерна, соответствующих разному гистологическому строению, то есть на фоне стандартного ямочного рисунка типа II-О можно выявить тип III (трубчатые или округлые ямки) или тип IV (разветвленные или извилистые ямки). В режиме NBI область дисплазии темнее из-за увеличения количества и диаметра поверхностных капилляров (Sano II) по сравнению с относительно гиповаскулярной фоновой картиной недиспластической SSA/P. При появлении дисплазии переход к инвазивному раку происходит в довольно короткие сроки даже в образованиях небольших размеров. В SSA/P, превышающих 20 мм, дисплазия встречается чаще (до 32,4%) [13].
Гистологическая диагностика. Гистологически SSA/P характеризуется распространением зубчатости на всю глубину крипт вплоть до базальных отделов и деформацией крипт с появлением признаков патологического ветвления, дилатации базальных отделов, горизонтального роста вдоль мышечной пластинки с образованием расширений в виде буквы L или перевернутой буквы Т. Зубчатость, как и в гиперпластических полипах, обусловлена выбуханием апикальной части цитоплазмы в просвет крипты. Зона пролиферации асимметрична, часто расположена на одной из стенок, смещена в среднюю треть крипты. Ядра несколько увеличены, с четкими ядрышками, возможны очаги псевдостратификации и дисплазии. Иногда встречаются небольшие очаги эозинофильных изменений, характерных для традиционной зубчатой аденомы (рис. 5). Минимальные критерии для диагностики SSA/P окончательно не определены, единственный однозначный признак — архитектурное искажение крипт (расширение базальных отделов или горизонтальный рост) при наличии зубчатости. С 2005 года диагностическим критерием для SSA/P считалось наличие не менее 10% измененных крипт. Согласно рекомендациям ВОЗ 2010 года, таким критерием признавалось наличие не менее двух измененных желез. Согласно современным рекомендациям, наличие даже одной измененной железы при ее зубчатости [4, 9, 13, 17].
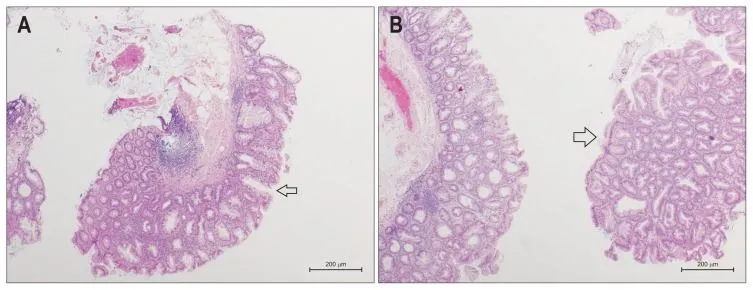
Рисунок 5. Гистологические особенности SSA/Р [13].
A. Зубчатая аденома (SSA/P) без дисплазии, демонстрирующая классические особенности широких оснований и расширенных крипт (указано стрелкой). Окраска гематоксилином и эозином, малое увеличение.
B. SSA/P с легкой дисплазией (указано стрелкой). Железистая архитектура и поверхностный эпителий диспластического компонента напоминает обычную аденому. Образец слева без дисплазии. Окраска гематоксилином и эозином, малое увеличение.
Традиционная зубчатая аденома (TSA)
Частота встречаемости TSA, по данным разных исследований, составляет 1,2–7%. Выявляются эти аденомы преимущественно в дистальной части толстой и прямой кишки, хотя могут быть расположены в любом отделе. TSA в большинстве случаев имеют вид полиповидного образования на ножке (0-Ip) или на широком основании (0-Is), но встречаются неполиповидные плоско-приподнятые образования (0-IIa). Полиповидные формы более характерны для дистальной части толстой кишки, а неполиповидные — для проксимальной [17].
Эндоскопически TSA чаще всего представлена полиповидным образованием ярко-красного цвета с виллезной поверхностью. При данном типе роста поверхность образования бывает коралловидной или в виде сосновой шишки. Ямочный рисунок IV типа, но может иметь II тип у основания. Благодаря этому различать полиповидные TSA и SSA/Р легко, но при этом IV тип рисунка поверхности вызывает трудности при дифференциальной диагностике со стандартными ворсинчатыми аденомами. Однако ямочный рисунок все-таки несколько отличается. В 1999 году, в дополнение к классификации Kudo, Т. Fujii выделил особые типы ямочного рисунка — IIIH и IVH — для характеристики поверхности TSA. Образования с типом ямочного рисунка IIIH (fern-like pit pattern) имеют хребтообразную, зазубренную поверхность, напоминающую лист папоротника, образования с типом IVH визуально напоминают шишку (pinecone-like appearance). Данные типы ямочного рисунка являются высоко специфичными для TSA: тип IIIH — в 93% случаях, а тип IVH — в 100% случаев соответствует диагнозу TSA (рис. 6) [1, 9, 17]. При осмотре в узком спектре (NBI) ярко-красные образования имеют темно-коричневую окраску из-за расширения капилляров, что так же делает их похожими на стандартные ворсинчатые аденомы. В то же время при осмотре в режиме NBI с увеличением.
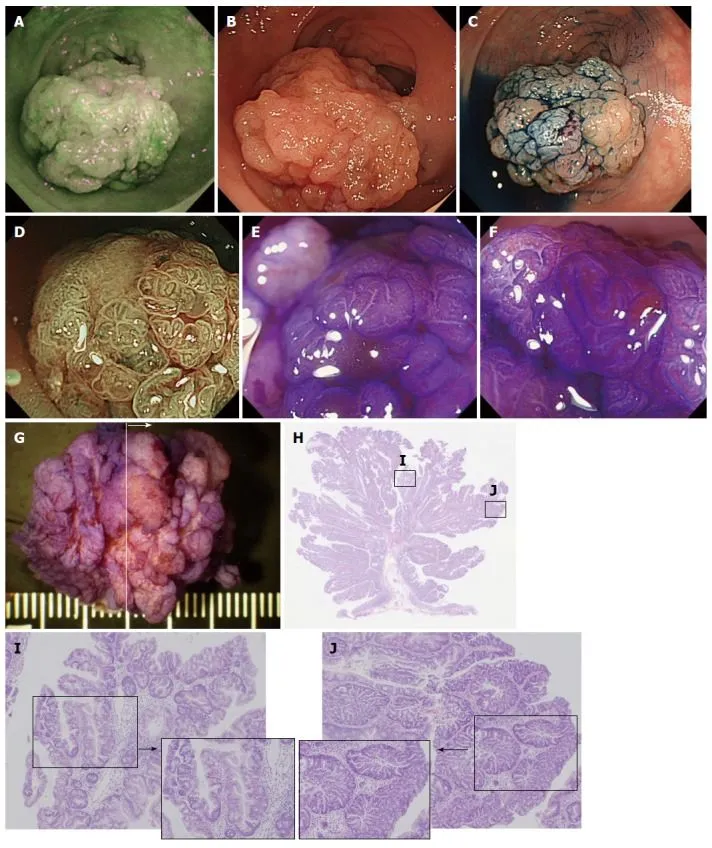
Рисунок 6. Традиционная зубчатая аденома [17].
A. Осмотр в режиме аутофлюоресценции. Образование имеет темно-зеленый тон, подобный окружающей неизмененной слизистой оболочке толстой кишки.
B. Осмотр в белом свете. В ректосигмоидном отделе визуализируется крупное (до 30 мм) полиповидное эпителиальное образование на зауженном основании красноватого цвета.
C. Хромоскопия с индигокармином. Четко визуализируется гранулярная структура поверхности.
D. Узкоспектральный осмотр (NBI) с увеличением. Образование имеет гранулярный рисунок поверхности с расширенным микрососудистым рисунком.
E, F. Хромоскопия с кристальным фиолетовым с увеличением. Ямочный рисунок типа IIIH или IVH.
G. Макропрепарат — удаленное образование. Проведена эндоскопическая резекция слизистой, образование разрезано на четыре части.
H. Окраска гематоксилином и эозином, образец №2.
I. Гистологические данные из окрашивания гематоксилином и эозином. Опухоль содержит зубчатые железы в слое слизистой оболочки. Диспластические изменения не наблюдаются.
J. Гистологические результаты его окрашивания. В нескольких точках могут наблюдаться TSA с традиционной эпителиальной дисплазией, проявляющей увеличенное скопление и псевдостратификацию ядер с диспластическими изменениями структуры крипты.
Морфологически TSA характеризуется наличием эктопических крипт, которые не достигают мышечной пластинки и придают образованию зубчатый вид. В большинстве случаев TSA имеет ворсинчатое строение, часто с отечными, булавовидно-расширенными на концах ворсинами — bulbous tips. Другой важный диагностический критерий — эозинофильные изменения: столбчатые клетки с эозинофильной цитоплазмой и центрально расположенным вытянутым ядром. Среди исследователей отсутствует единое мнение относительно их природы: дисплазия, метаплазия, покоящиеся клетки (рис. 6, 7). Следует отметить, что описаны образования, имеющие только один из указанных признаков на фоне классической аденомы, а 18% TSA имеют очаги, схожие по строению с тубулярной аденомой [22]. Их возможная роль в развитии зубчатых образований из классических аденом пока не выяснена. Описаны также TSA, эпителий которых представлен в основном бокаловидными клетками (рис. 3 — Е) [6]. Независимо от описанных эозинофильных изменений в TSA могут присутствовать очаги традиционной дисплазии разной степени тяжести [17].
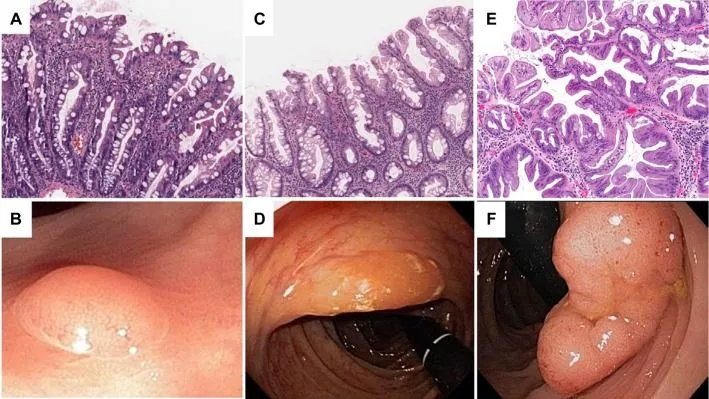
Рисунок 7. Гистологическая и эндоскопическая картина зубчатых неоплазий толстой кишки [16].
A, B. Гиперпластический полип.
C, D. Зубчатая аденома на широком основании.
E, F. Традиционная зубчатая аденома.
Выводы
Зубчатые образования разделены на три подтипа: гиперпластические полипы (HP), зубчатые аденомы на широком основании (SSA/P) и традиционные зубчатые аденомы (TSA). По всей видимости, HP не обладают злокачественным потенциалом. Развитие КРР из SSA/P и TSA идет по зубчатому пути канцерогенеза, который обусловливает 15–30% всех спорадических КРР. Наиболее распространенным типом зубчатых образований толстой кишки являются HP, чаще всего представленные образованиями 0-Is или 0-IIa типа (по Парижской классификации) бледно-розового цвета с ямочным рисунком II типа, размерами до 5 мм. НР, как правило, локализованы в левых отделах толстой кишки. При этом крайне сложно провести дифференциальную диагностику между HP и SSA/P не только на макроскопическом, но и на микроскопическом уровне. Поэтому все подобные образования диаметром более 5 мм и/или с локализацией проксимальнее селезеночного изгиба ободочной кишки должны рассматриваться как SSA/P даже при выявлении HP при гистологическом исследовании. SSA/P представлены неполиповидными (0-II типов по Парижской классификации) образованиями бледно-розового цвета, покрытыми шапочкой желтоватой слизи и окруженными ободком мусора. К признакам SSA/P также относятся «облачная», или «кружевная», поверхность, нечеткие контуры. Недиспластические SSA/P имеют регулярный ямочный рисунок типа II-О, появление в центре или на периферии SSA/P ямочного рисунка другого типа свидетельствует о наличии дисплазии. Развитие аденокарциномы в диспластической SSA/P происходит в довольно короткие сроки. Излюбленная локализация SSA/P — правые отделы толстой кишки. Пропущенные SSA/P являются частой причиной интервального рака. Для выявления SSA/P необходима особо тщательная подготовка толстой кишки к исследованию. Полиэтиленгликоль с аскорбатным комплексом (МОВИПРЕП®) в разделенной дозе или по утренней одноэтапной схеме повышает частоту выявления SSA/P. Из всех зубчатых образований толстой кишки TSA имеют наименьшую распространенность, но обладают наибольшим злокачественным потенциалом. TSA чаще всего представлены полиповидными (0-Ip, 0-Is типа) образованиями коралловидной формы или в форме еловой шишки. Излюбленная локализация TSA — левые отделы толстой кишки, однако TSA могут встречаться и в правых отделах, где чаще имеют неполиповидную форму. Обычно TSA — это образования красноватого цвета с виллезной поверхностью. Дифференциальный диагноз TSA и SSA/P несложен. Трудности вызывает дифференциальный диагноз TSA и стандартных аденом на макроскопическом уровне. TSA имеет некоторое отличие ямочного рисунка, который напоминает лист папоротника (IIIH тип) или шишку (IVH тип). Также при детальном рассмотрении в TSA выявляются ямки II-O типа.
Рекомендуем по теме:
- Классификация WASP: дифференциальная диагностика гиперпластических полипов, зубчатых аденом и обычных аденом толстой кишки.
- Классификация WASP: видео-практикум
- Обзор. Стратегии клинического наблюдения после эндоскопического лечения зубчатых аденом толстой и прямой кишки
- Видео: BASIC (BLI Adenoma Serrated International Classification) классификация колоректальных полипов Video
Список литературы:
1. Агейкина Н.В., Дуванский В.А., Князев М.В. Альтернативный путь развития колоректального рака. Эндоскопические и морфологические особенности зубчатых поражений (обзор литературы) // Клиническая и экспериментальная гастроэнтерология. — 2013. — №8. — С. 3–10. «КиберЛенинка»: https://cyberleninka.ru/article/n/alternativnyy-put-razvitiya-kolorektalnogo-raka-endoskopicheskie-i-morfologicheskie-osobennosti-zubchatyh-porazheniy-obzor.
2. Зобнина М.В., Черкасова Л.М., Сапелкин А.П. Эндоскопическая диагностика зубчатых неоплазий толстой кишки : тезисы конференции «Актуальные вопросы эндоскопии». URL: https://rusendo.ru/ru/archive/theses-ru/68-2015-god/tonkaya-i-tolstaya-kishka-krovotecheniya-iz-tonkoj-kishki-polipy-tolstoj-kishki/671-endoskopicheskaya-diagnostika-zubchatykh-neoplazij-tolstoj-kishki.html.
3. Кит О.И., Бодолажский Д.И., Двадненко К.В., Ефимова И.И., Олейникова Е.Н., Олейников Д.Д., Тимошкина Н.Н. Аберрантное метилирование промоторных участков генов apc, cdh13 и mgmt у больных колоректальным раком // Сибирский онкологический журнал. — 2016. — Т. 15. — №2. — С. 48–55. DOI: 10.21294/1814-4861-2016-15-2-48-55.
4. Харлова О.А., Данилова Н.В., Мальков П.Г., Агейкина Н.В., Князев М.В. Зубчатые образования (serrated lesions) толстой кишки // Архив патологии. — 2015. — №77 (1). — С. 60–68. URL: https://www.mediasphera.ru/issues/arkhiv-patologii/2015/1/downloads/ru/090004-195520150110. DOI: 10.17116/patol201577160-.
5. Clark B.T., Laine L. High-quality bowel preparation is required for detection of sessile serrated polyps. Clin Gastroenterol Hepatol. 2016. 14: 1155–1162. DOI: 10.1016/j.cgh.2016.03.044.
6. East J.E., Atkin W.S., Bateman A.C., Clark S.K., Dolwani S., Ket S.N., Leedham S.J., Phull P.S., Rutter M.D., Shepherd N.A., Tomlinson I., Rees C.J. British Society of Gastroenterology position statement on serrated polyps in the colon and rectum. Gut. 2017. Jul; 66 (7): 1181–1196. DOI: 10.1136/gutjnl-2017-314005. Epub 2017 Apr 27. PMID: 28450390. PMCID: PMC5530473. DOI: 10.1136/gutjnl-2017-314005.
7. Fidalgo C., Santos L., Rosa I., Fonseca R., Lage P., Claro I., Chaves P., Dias Pereira A. Hyperplastic polyp? Look again... the impact of the new classification for serrated polyps. Acta Med Port. 2014. May-Jun; 27 (3): 304–308. Epub 2014 Jun 30. PMID: 25017341.
8. Hassan C., Bretthauer M., Kaminski M.F., Polkowski M., Rembacken B., Saunders B., Benamouzig R., Holme O., Green S., Kuiper T., Marmo R., Omar M., Petruzziello L., Spada C., Zullo A., Dumonceau J.M.; European Society of Gastrointestinal Endoscopy. Bowel preparation for colonoscopy: European Society of Gastrointestinal Endoscopy (ESGE) guideline. Endoscopy. 2013; 45 (2): 142–150. Epub 2013 Jan 18. PMID: 23335011. DOI: 10.1055/s-0032-1326186.
9. Ishigooka S., Nomoto M., Obinata N., Oishi Y., Sato Y., Nakatsu S., Suzuki M., Ikeda Y., Maehata T., Kimura T., et al. Evaluation of magnifying colonoscopy in the diagnosis of serrated polyps. World J Gastroenterol. 2012. 18: 4308–4316.
10. Kim S.Y., Kim T.I. Serrated neoplasia pathway as an alternative route of colorectal cancer carcinogenesis. Intest Res. 2018. Jul; 16 (3): 358–365. Epub 2018 Jul 27. PMID: 30090034 PMCID: PMC6077295. DOI: 10.5217/ir.2018.16.3.358.
11. Kimura T., Yamamoto E., Yamano H.O., Suzuki H., Kamimae S., Nojima M., Sawada T., Ashida M., Yoshikawa K., Takagi R., et al. A novel pit pattern identifies the precursor of colorectal cancer derived from sessile serrated adenoma. Am J Gastroenterol. 2012. 107: 460–469.
12. Kojecky V., Dastych M., Zadorova Z., Varga M., Hajer J., Kment M., Kroupa R., Kunovska M., Matous J., Misurec M., Hep A., Kianicka B., Latta J. [Effective bowel preparation before coloscopy — low-volume PEG in the divided dose regimen]. Vnitr Lek. 2016. Apr; 62 (4): 249–254. PMID: 27250601.
13. Ma M.X., Bourke M.J. Sessile Serrated Adenomas: How to Detect, Characterize and Resect. Gut Liver. 2017. Nov 15; 11 (6): 747–760. PMID: 28494577. PMCID: PMC5669590. DOI: 10.5009/gnl16523.
14. Niv Y. Changing pathological diagnosis from hyperplastic polyp to sessile serrated adenoma: systematic review and meta-analysis. Eur J Gastroenterol Hepatol. 2017. Dec; 29 (12): 1327–1331. PMID: 29049128. DOI: 10.1097/MEG.0000000000000994.
15. O'Connell B., Hafiz N., Crockett S. The Serrated Polyp Pathway: Is It Time to Alter Surveillance Guidelines? Curr Gastroenterol Rep. 2017. Aug 29; 19 (10): 52. PMID: 28853002. PMCID: PMC5642051. DOI: 10.1007/s11894-017-0588-3.
16. O'Connell B.M., Crockett S.D. The clinical impact of serrated colorectal polyps. Clin Epidemiol. 2017. Feb 22; 9: 113–125. eCollection 2017. PMID: 28260946. PMCID: PMC5327852. DOI: 10.2147/CLEP.S106257.
17. Saito S., Tajiri H., Ikegami M. Serrated polyps of the colon and rectum: Endoscopic features including image enhanced endoscopy. World J Gastrointest Endosc. 2015. Jul 25; 7 (9): 860–871. PMID: 26240687. PMCID: PMC4515420. DOI: 10.4253/wjge.v7.i9.860.
18. Siddiki H., Ravi S., Al-Qaisi M.T., Fath A.R., Ramirez F., Crowell M.D., Pannala R., Faigel D.O., Gurudu S.R. Comparison Versus Large Volume for Colonoscopy: A Study Outcomes. Dig Dis Sci. 2018. May 7. PMID: 29736830 DOI: 10.1007/s10620-018-5102-8.
19. Xie Q., Chen L., Zhao F., Zhou X., Huang P., et al. (2014) A Meta-Analysis of Randomized Controlled Trials of Low-Volume Polyethylene Glycol plus Ascorbic Acid versus Standard-Volume Polyethylene Glycol Solution as Bowel Preparations for Colonoscopy. PLoS One.9 (6): e99092. DOI: 10.1371/journal.pone.0099092.
20. Ponchon T. et al. A low-volume polyethylene glycol plus ascorbate solution for bowel cleansing prior to colonoscopy: The NORMO randomised clinical trial. Digestive and Liver Disease. 45 (2013): 820–826.
21. Ell C. et al. Randomized Trial of Low-Volume PEG Solution Versus Standard PEG + Electrolytes for Bowel Cleansing Before Colonoscopy. American Journal of Gastroenterology. 2008. Apr; 103 (4): 883–893.
22. Spring K.J., Zhao Z.Z., Karamatic R., Walsh M.D., Whitehall V.L., Pike T. et al. High prevalence of sessile serrated adenomas with BRAF mutations: a prospective study of patients undergoing colonoscopy. Gastroenterology. 2006. 131 (5): 1400–1407.
Рекомендуемые статьи
Синдром Баррета
слизистая пищевода с островками эктопии цилиндрического эпителия, пептический эзофагит, аксиальная грыжа
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.










.jpg)




.png)


















Комментарии 3