- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: СТЕНТИРОВАНИЕ ПРИ ЗАБОЛЕВАНИЯХ ТОЛСТОЙ КИШКИ
| Авторы: | Е.А. Дробязгин 1 |
| Об авторах: |
1. Врач-эндоскопист, Доктор медицинских наук, профессор кафедры госпитальной и детской хирургии НГМУ, заведующий отделения эндоскопии ГБУЗ НСО «ГНОКБ» |
Аннотация:
С момента появления в 1990-х годах непокрытых саморасширяющихся металлических стентов (СРМС) их конструктивные особенности претерпели значительные изменения. Применение новых материалов и новых конструкций расширило показания для использования СРМС. Сейчас толстокишечные стенты считаются эксклюзивным методом паллиативной помощи при обструкции толстой кишки, а многочисленные типы этих стентов разрабатываются для применения в различных клинических ситуациях, а не только для стентирования с паллиативной целью. В публикации рассматривается стентирование толстой кишки сегодня и будущие направления развития этой методики.
Введение:
С момента разработки и экспериментального использования СРМС в 1990-х годах стенты значительно изменились. Изначально они были разработаны для обеспечения проходимости различных отделов желудочно-кишечного тракта при опухолевой обструкции. В случае обструкции просвета толстой кишки при опухолевом поражении применялось оперативное вмешательство с формированием колостомы. Частота интра- и послеоперационных осложнений оставалась достаточно высокой, что безусловно увеличивало частоту летальных исходов. Все это способствовало разработке и внедрению в клиническую практику методик стентирования [81].
Сегодня эндоскопическое стентирование — метод выбора в лечении пациентов с опухолевой кишечной непроходимостью при невозможности выполнения оперативного вмешательства. Разрабатывается большое количество стентов для более широкого клинического применения, которое не ограничено лишь паллиативными целями.

Полный текст статьи:
Ключевые слова: толстая кишка, кишечная непроходимость, стенты, саморасширяющиеся металлические стенты.
Материалы для изготовления стентов
Большинство стентов, используемых при стентировании толстой кишки, — СРМС. Из-за особенностей плетения стента задается радиальная сила, обеспечивающая его раскрытие и удержание в просвете кишки. Применение стентов из других материалов (например, силикон) и их установка невозможны. СРМС устанавливаются через инструментальный канал эндоскопа в системе доставки в область сужения, позиционируются в нужное положение под эндоскопическим, рентгеновским или сочетанным контролем, после чего происходит постепенное раскрытие стента путем стягивания оболочки.
Чаще всего системы доставки у фирм-производителей одинаковы. Различаются материал, из которого они изготовлены, и покрытие.
Стенты изготавливают из нержавеющей стали, никелида титана и сплава кобальта, хрома или никеля.
Стенты из нержавеющей стали. Z-stent® (Cook Medical, США; rainbowvisionmedical.com) (рис. 1) — типичный СРМС из нержавеющей стали. Z-stent® был первым самораскрывающимся металлическим стентом и все еще доступен как в закрытых, так и в непокрытых формах. Между тем СРМС из нержавеющей стали относительно жесткие и делают невозможным проведение МРТ-исследований.

Рис. 1. Z-stent®.
Никелид-титановые стенты. Эти стенты изготовлены из сплава титана и никеля (рис. 2), примеры: Ultraflex (Boston Scientific, США), Alimaxx-E stents (Alveolus, США), Ella-CS (www.diytrade.com). С учетом особенностей сплава они могут слабо визуализироваться при рентгенологическом исследовании и поэтому имеют на своей поверхности рентгенконтрастные метки. У этих стентов хорошая гибкость. Их недостатки, как и у металлических, Недостатками этих стентов, как и у металлических, — невозможность выполнения МРТ-исследования [1, 4, 18, 20, 23, 25, 47].

Рис. 2. Никелид-титановый частично покрытый стент.

Рис. 3. Wallstent.
По особенностям покрытия выделяют два вида: покрытые (рис. 4) и непокрытые стенты. Первые имеют силиконовое покрытие — частичное или полное. Покрытые стенты могут использоваться при закрытии свищевых отверстий, но риск их миграции выше, чем у непокрытых стентов. Для уменьшения частоты миграции разработаны частично покрытые стенты — у них полимерное покрытие имеется только на теле, а на концах отсутствует (рис. 2). По мнению нескольких авторов [63, 75, 78], убедительных данных о преимуществах того или иного вида стента не обнаружено.

Рис. 4. Полностью покрытый толстокишечный стент M.I. Tech.
В 2012 году Zhang Y. с соавторами провел метаанализ результатов колоректального стентирования с использованием различных видов стентов, согласно которому прорастание чаще возникает при использовании непокрытых стентов, а миграция — при использовании покрытых [47, 121]. В таблице 1 представлены результаты проведенного метаанализа.
Табл. 1. Сравнение эффективности и осложнений при использовании покрытых и непокрытых стентов.
|
Исследование |
Кол-во пациентов |
Вид стента |
Вид исполь-зования |
Средний возраст пациентов |
Тип покрытия |
Значимые различия между стентами |
Осложнения |
|
26 |
Не указано |
Паллиативное
|
58 |
Полное/частичное (полиуретан) |
Нет |
Большая частота миграции при установке покрытого стента | |
|
74 |
Choo stent™ |
Паллиативное |
60 |
Полное/частичное (полиуретан) |
Нет |
Большая частота миграции при установке покрытого стента | |
|
80 |
Niti-S™ |
Паллиативное
|
63,3 |
Частичное (полиуретан) |
Нет |
Большая частота миграции при установке покрытого стента | |
|
151 |
WallFlex™ Comvi™ |
Паллиативное
|
61,4 |
Частичное (полифто-рэтилен) |
Нет |
Врастание опухоли чаще при использовании непокрытых стентов; большая частота миграции при установке покрытого стента | |
|
68 |
Niti-S™ D-type Comvi™ |
Паллиативное
|
65,8 |
Частичное (полифто-рэтилен) |
Нет |
Большая частота миграции при установке покрытого стента | |
|
103 |
Wallstent™ Niti-S™ Bonastent™ Hanarostent®
|
Паллиативное |
67,3 |
Частичное (полифто-рэтилен или силикон) |
Нет |
Нет разницы между частой миграции и видом стента | |
|
152 |
Niti-S™
Choo stent™ Bonastent™ |
Паллиативное
|
70 |
Не указано |
Нет |
Большая частота миграции и перфорации при установке покрытого стента |
* BTS (bridge to surgery, bridge-терапия) — стентирование используется как подготовка к операции.
Выбор стента
С учетом большого количества и вариантов колоректальных стентов важно выбрать подходящий стент, так считают многие исследователи [27, 40, 51, 85, 86, 97]. Но, поскольку единого мнения по этому вопросу нет, необходимо проведение крупномасштабных исследований, по результатам которых может быть выбран оптимальный вид стента [47].
Показания для колоректального стентирования
В настоящее время установка колоректального стента может быть произведена при злокачественных новообразованиях толстой кишки как с паллиативной целью, так и для предоперационной подготовки (bridge-терапия) [3, 6, 9, 15, 28, 31, 39, 46, 85–88, 93, 97, 67, 99, 110, 117, 119].
Стентирование при колоректальном раке (КРР)
Чаще всего установка стента выполняется при левостороннем поражении толстой кишки опухолью. По мнению Kim E.J., Kim Y.J., состояние пациентов с локализацией опухоли в левой половине кишки более тяжелое [47]. Авторы ссылаются на то, что чаще при раке правой половины ободочной кишки вмешательства выполняются в один этап и не требуют колостомии. По мнению других авторов [6, 15, 31, 46, 85, 93,67, 117, 119], стентирование возможно и при раке правой половины ободочной кишки. В частности, Dronamraju S.S. с соавторами указывают на высокую эффективность стентирования правой половины ободочной кишки [24].
Стентирование с паллиативной целью — хорошая альтернатива хирургическим методам для обеспечения проходимости кишки при ее обструкции. С момента начала применения СРМС в 1990-х годах по настоящее время ближайшие и отдаленные результаты этого метода остаются предметом дискуссии. В работе Liberman H. и соавторов [66] показана высокая эффективность этого метода лечения. Ряд исследований свидетельствует, что достоверной разницы между установкой стента или хирургическим лечением не отмечено, но частота осложнений и длительность госпитализации была ниже в группе пациентов, которым проводили стентирование [12, 25, 59, 76]. В других исследованиях сообщалось о том, что продолжительность жизни в группах пациентов не различалась, а частота осложнений и летальность были меньше в группе пациентов, которым устанавливались стенты [49, 83].
Следует учитывать и отдаленные результаты при колоректальном стентировании. Так, в работах Lee H.J. и соавторов имеется указание на высокую эффективность стентирования при КРР, несмотря на повторную установку стента [59]. Однако в исследовании 168 пациентов, которым установили СРМС в качестве паллиативной помощи или предоперационной подготовки, у 41 больного (24,4%) в паллиативной группе были осложнения, в том числе перфорации, окклюзии, миграции и язвы, а средняя проходимость стента составила 145 дней [94]. В другом исследовании, посвященном долгосрочным клиническим результатам установки СРМС, осложнения, такие как миграция, окклюзия, перфорация и тенезмы, в отдаленном послеоперационном периоде были у 51% пациентов [26].
При принятии решения о стентировании необходимо учитывать высокий риск осложнений у пациентов, которым проводится химиотерапия. В частности, препарат бевацизумаб может увеличивать риск перфорации кишки [13, 42, 56, 67]. В исследовании Small A.J. и соавторов говорится о значительной разнице в выживаемости между паллиативной хирургией и установкой СРМС у пациентов с неизлечимым КРР [96-98]. В этом исследовании у группы пациентов, которым были установлены СРМС, отмечена меньшая длительность пребывания в стационаре (при условии, что химиотерапия не проводилась). Согласно этим исследованиям, установка СРМС имеет хороший терапевтический эффект у пациентов, которым не проводят паллиативную химиотерапию.
На основании изложенного можно сделать вывод о высокой эффективности стентирования при злокачественной толстокишечной непроходимости с паллиативной целью из-за малой частоты осложнений и лучшего качества жизни. В то же самое время нужно быть готовым к коррекции возможных осложнений (например, стентированию «стент в стент») [47].
Стентирование как предоперационная подготовка (bridge to surgery). Следует учитывать, что 10–30% пациентов с раком толстой кишки имеют признаки кишечной непроходимости и требуют экстренной операции, несмотря на наличие сопутствующей патологии [21]. Вмешательство в условиях кишечной непроходимости имеет высокий процент послеоперационных осложнений (32–64%) и летальности (15–34%) [28, 73]. Установка стента у пациентов с опухолевой кишечной непроходимостью позволяет устранить непроходимость, улучшить состояние больного, провести его обследование с детальной оценкой состояния. Рядом исследований убедительно доказана эффективность этого метода [3, 9, 28, 39, 85–88, 97, 67, 99, 110].
По данным Watt A.M. и соавторов [112], этот метод имеет высокую эффективность по сравнению с операциями по экстренным показаниям, поскольку позволяет выполнить первичный анастомоз. Кроме того, длительность пребывания в больнице была меньшей в группе пациентов, которым были установлены СРМС, а частота выполнения колостомии — выше в группе пациентов, которые были оперированы по экстренным показаниям.
Tilney H.S. и соавторы [102] сравнивали предоперационную подготовку с установкой стента и стандартное вмешательство и сделан вывод о снижении длительности пребывания пациентов в стационаре, а также снижении частоты послеоперационных осложнений и выполнения колостомии при стентировании. По данным других авторов [92, 101, 104], в рандомизированных контролируемых исследованиях отмечено снижение частоты колостомии и увеличение числа первичных анастомозов. При этом летальность и частота осложнений не отличались. Иными авторами [82, 118, 121, 122] получены противоречивые сведения о использовании стентирования. При анализе 181 случая лечения пациентов с опухолью левой половины ободочной кишки имеются указания на высокий риск осложнений [47]. В другом исследовании [32], оценивающем риск возникновения рецидива при использовании BTS, отмечен больший процент местного рецидива при применении СРМС. Таким образом, методика установки стента в качестве BTS может быть использована, но остается предметом дискуссии, и окончательное решение также остается предметом обсуждения, особенно в вопросе лечения пациентов, которым требуется установка нескольких стентов для декомпрессии.
Рецидив рака после ранее выполненной операции. Частота рецидивов в зоне анастомоза после резекции низкая [54]. При обструкции анастомоза опухолью варианты лечения обсуждаются: при рецидиве опухоли в зоне анастомоза явления обструкции присутствуют у небольшого числа пациентов [114] — и чаще для лечения этой категории пациентов могут быть рассмотрены варианты баллонной дилатации, повторного вмешательства или медикаментозной декомпрессии в зависимости от тяжести симптомов [29].
В ряде публикаций имеются сведения о высокой эффективности стентирования при стенозе анастомоза [7, 30, 34, 105]. В 2014 году Kim J.H. с соавторами было опубликовано ретроспективное исследование, включившее пять пациентов с рецидивом рака в зоне кишечного анастомоза. Во всех случаях удалось добиться раскрытия стента и разрешения кишечной непроходимости, а отдаленная эффективность составила 60% [50].
Несмотря на небольшое число клинических наблюдений, многие авторы указывают на использование СРМС у пациентов с рецидивом КРР и явлениями обструкции кишки [1, 3, 7, 20, 35, 47].
Стентирование при доброкачественных заболеваниях Эффективность установки СРМС при доброкачественных заболеваниях толстой кишки не ясна. Публикации описывают лишь единичные случаи подобного [44, 64, 79, 67].
В частности, в работе Paul L. и соавторов [79] сообщается о 10 случаях применения СРМС при доброкачественных заболеваниях толстой кишки: в двух случаях при дивертикулите, осложненном абсцессом таза, в четырех случаях при свищах толстой кишки и четырех случаях сужения межкишечных анастомозов. Пациентов с абсцессом излечить удалось, но в обоих случаях развивались свищи. Лишь у двух пациентов со свищами толстой кишки отмечена положительная динамика, а симптомы обструкции были разрешены у всех четырех пациентов [79]. В исследовании Small A.J. и соавторов стенты были успешно установлены в 95% ситуаций, но частота осложнений составила 38%, включая миграцию, повторную обструкцию и перфорацию кишки. В заключение авторами делаются выводы о возможности применения СРМС, но с высокой частотой осложнений [97]. Низкий показатель эффективности (76%) и высокий процент осложнений (46%) продемонстрирован в исследовании Keranen I. и соавторами [44].
Таким образом, применение СРМС у пациентов с доброкачественными заболеваниями толстой кишки целесообразно с целью предоперационной подготовки либо в случае, если у них высок риск осложнений после хирургического вмешательства.
Стентирование при сдавлении кишки извне. Энтеральное стентирование также может быть использовано у некоторых пациентов с обструкцией толстой кишки опухолями другой локализации [53], поскольку они тоже могут нарушать проходимость кишки.
В ряде публикаций проведена оценка результатов имплантации СРМС пациентам со сдавлением толстой кишки извне. При этом показатели технической успешности стентирования были различны (42–100%), а эффективность стентирования была в пределах 25–87,5% [10, 45, 52, 74, 96, 106].
В исследовании 2011 года имеются указания о технической невозможности стентирования при компрессии толстой кишки у пациенток женского пола и о низкой его эффективности по сравнению с группой пациентов с опухолевым поражением толстой кишки, которых также стентировали [70]. Miyayama S. с соавторами оценивали эффективность стентирования 20 пациентов с перитонеальным карциноматозом. 90% больных удалось установить стент, средняя продолжительность жизни составила 119 дней [74].
Следовательно, при установке стентов в случае обструкции толстой кишки извне необходимо быть готовым к тому, что эффективность стентирования может быть ниже и этот вариант помощи может быть использован в отдельных случаях.
Методика выполнения вмешательства. Пероральная подготовка толстой кишки с помощью различных средств у пациентов с острой толстокишечной непроходимостью приводит к перфорации проксимальных отделов толстой кишки и аспирации. Однако при частичной непроходимости применение таких препаратов возможно [60].
Установка СРМС выполняется двумя основными методами: эндоскопическое стентирование по инструментальному каналу рабочего эндоскопа (through-the-scope, TTS) и стентирование по направляющей струне под рентгенологическим контролем (over-the-guidewire, OTW, или non-through-the-scope, non-TTS) [60, 108].
Методика OTW наиболее часто используется при дистальном левостороннем поражении [11, 35]. Струна-проводник (guidewire) по направляющему катетеру проводится и устанавливается за область колоректального стеноза. Затем, после удаления катетера, по струне проводится доставочное устройство, и стент высвобождается путем стягивания наружной оболочки [1, 35].
Очень важно правильно выбрать размер СРМС: стент должен быть на 4–6 см длиннее протяженности опухолевой стриктуры, а его концы должны отстоять на 2–3 см от края опухоли [35]. Другой важный факт — степень укорочения стента, которая может составлять 20–45% [62]. Важен также выбор диаметра СРМС для обеспечения эффективной декомпрессии — он должен быть не менее 24 мм [97, 67]. Если раскрытие стента неадекватно, можно установить дополнительный стент, чтобы полностью перекрыть участок опухолевого поражения. Применение СРМС с меньшим диаметром увеличивает риск их миграции после установки [71, 97, 67, 99, 108].
B дистальных отделах сигмовидной кишки и прямой кишке раскрытие стента может проводиться только при рентгеноскопическом или эндоскопическом контроле. В проксимальных отделах толстой кишки из-за особенностей строения некоторыми авторами указывается возможность сочетанного применения методик контроля за раскрытием стента. Эндоскопический контроль, по мнению ряда исследователей, необходим для того, чтобы пройти за участок сужения и установить струну-проводник, хотя проведение аппарата за участок сужения не является необходимым.По мнению de Gregorio M.A. с соавторами [20], установка стента в дистальных отделах должна проводиться с обязательным рентгенологическим контролем без применения эндоcкопии.
Как правило, вмешательство не требует общей анестезии. У пациентов с тревожным состоянием или высокой болевой чувствительностью возможно применение в качестве седативного средства препарата мидазолам или обезболивание.
При использовании только рентгенологического метода для определения длины пораженного опухолью сегмента кишки применяются водорастворимые контрастные вещества, которые вводятся через ангиографический катетер по предварительно установленной 0,035-дюймовой гидрофильной жесткой струне-проводнику. Катетер и струна-проводник устанавливаются через прямую кишку к участку сужения [20]. При извилистости хода возможно применение дополнительных направляющих струн. При установке катетера максимально близко к участку сужения производится введение контрастного вещества. Для улучшения визуализации при раскрытии стента возможна маркировка проксимального и дистального участков сужения.
Стент и систему доставки выбирают на основании данных рентгенологического исследования. После установки струны-проводника за участок сужения стент в системе доставки устанавливается в нужный участок (рис. 5).
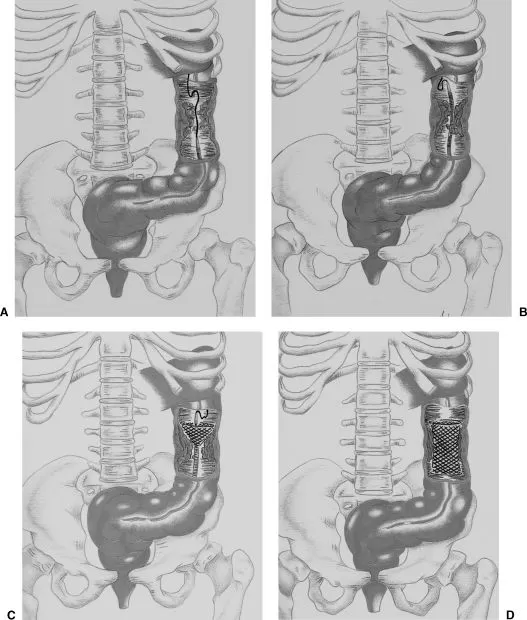
Рис. 5. Сужение просвета нисходящей ободочной кишки [20].
A. Проводник и катетер установлены за зону сужения.
B. По струне-проводнику за участок сужения установлено доставочное устройство стента.
C. Стент позиционирован таким образом, что его проксимальный край расположен выше участка сужения.
D. Стент полностью раскрыт.
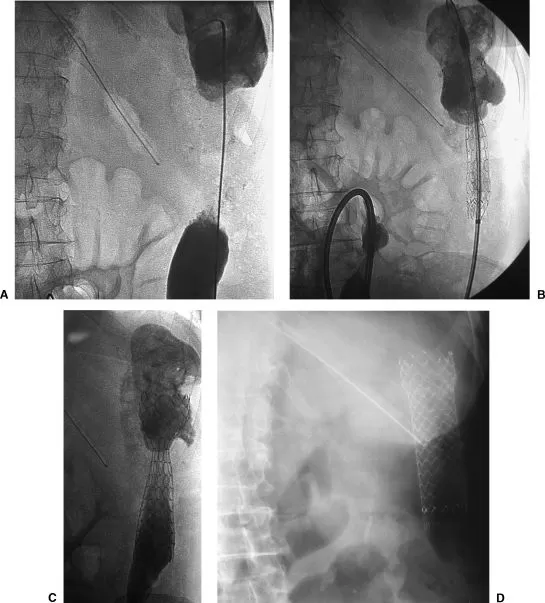
Рис. 6. [20]
A. Опухоль нисходящей ободочной кишки. Проводник установлен выше участка сужения.
B. Установка доставочного устройства стента в зону сужения.
C. Стент полностью раскрыт и частично расправлен.
D. Рентгенологически подтверждено полное раскрытие стента.
При использовании методики TTS струна и система доставки проводятся через инструментальный канал колоноскопа, а раскрытие стента осуществляется как под эндоскопическим, так и при необходимости под рентгенологическим контролем (рис. 7).
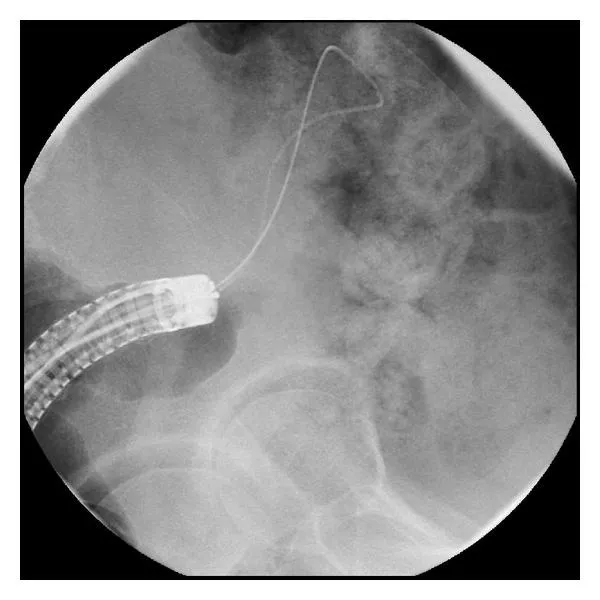
Рис. 7. Методика выполнения стентирования с использованием эндоскопа [114]. ##Андрей, здесь нужно нарисовать a, b, c##
A. Проводник установлен за пределы опухоли.
B. Система доставки проведена за участок стеноза.
C. Стент раскрыт в зоне сужения.
При сравнении методик отмечается одинаковая частота успешных установок, но наибольшая эффективность и простота отмечены при стентировании под эндоскопическим или сочетанным контролем [31, 60, 62, 93, 108], особенно при поражениях проксимальнее ректосигмоидного изгиба [31].
Клиническая оценка эффективности стентирования производится на основании разрешения симптомов кишечной непроходимости: отхождения стула и газов, уменьшения вздутия живота. В течение 2–3 суток после выполнения процедуры обязательна обзорная рентгенография брюшной полости — для оценки степени расправления СРМС, подтверждения декомпрессии кишечника, исключения перфорации [14].
При сочетанном использовании проводник может быть установлен за участок сужения под эндоскопическим контролем — в случае изгибов в области сужения или локализации поражения в верхних отделах нисходящей части, поперечной ободочной кишке [5].
После раскрытия стента дополнительная баллонная дилатация не рекомендуется из-за высокого риска перфорации. Особенность саморасправляющихся стентов — их медленное расширение с течением времени. Перистальтические движения толстой кишки после декомпрессии могут способствовать этому процессу [20].
Осложнения колоректального стентирования. Частота возникновения летального исхода при колоректальном стентировании не превышает 1% [19, 23], но установка стента может быть сопряжена с такими осложнениями, как перфорация, миграция, врастание опухоли, нарушение стула, кровотечение и болевой синдром. Общая частота осложнений, связанных с процедурой, может достигать 25% [93].
Отсутствие эффекта от стентирования. Несмотря на полное раскрытие стента, декомпрессии может так и не наступить. Причинами этого могут быть неправильный подбор стента по длине и, как следствие, раскрытие не всей стриктуры, наличие дополнительных участков стеноза, миграции стента или фекальной инконтиненции [4, 5]. Оптимально, по мнению ряда авторов, применение рентгенологического исследования с использованием водорастворимого контраста перед стентированием или в процессе его выполнения [4]. В таких ситуациях повторное стентирование может разрешить возникшую проблему. Yoon J.Y. с соавторами, сравнивая результаты повторного стентирования по отношению к паллиативному хирургическому, подчеркивают эффективность эндоскопического вмешательства, в том числе и низкий процент летальных исходов, несмотря на не всегда полноценное восстановление проходимости [118, 119].
Перфорация. Перфорация — наиболее серьезное осложнение колоректального стентирования. Частота перфорации составляет от 0 до 83%. В исследовании Watt A.M. при оценке результатов колоректального стентирования путем метаанализа частота возникновения перфорации была 5% [112]. При этом частота летальных исходов составляет 16% [5, 19].
Принято выделять два вида перфорации: происходящую при установке стента и отсроченную.
Причины возникновения первого вида перфорации чаще всего технические и связаны с неправильным проведением исследования или установкой струны-проводника, либо ее заменой в процессе выполнения вмешательства. По мнению ряда авторов, при возникновении отсроченной перфорации вид стента и его размещение при установке оказывают решающее влияние [34, 36, 87]. Примером может служить ситуация, при которой СРМС устанавливается в зоне ректосигмовидного перехода, зоны с острым углом. Другая причина возникновения перфорации — чрезмерная инсуффляция воздуха при исследовании или вмешательстве. Поэтому ограничение подачи воздуха может позволить избежать перфорации [5].
При выявлении перфорации требуется экстренная помощь. При этом в двух третях случаев при отсроченной перфорации пациентам необходимо оперативное вмешательство. Лишь в трети случаев — при наличии микроперфорации в условиях стентирования — возможно проведение консервативного лечения с применением антибактериальной терапии [67]. Ранее указывалось о высоких рисках отсроченной перфорации у пациентов, проходящих химиотерапию на фоне стентирования [13, 71, 97, 67, 99].
Причинами обструкции стента или окклюзии его краев могут быть врастание опухоли в просвет стента или разрастание по проксимальному или дистальному краям. Эта ситуация чаще бывает при использовании непокрытых стентов [116, 121, 122]. При невозможности удаления опухоли рост ее продолжается, что и приводит к данному осложнению. В такой ситуации возможно хирургическое вмешательство, либо стентирование по типу «стент в стент» (рис. 8) [122].
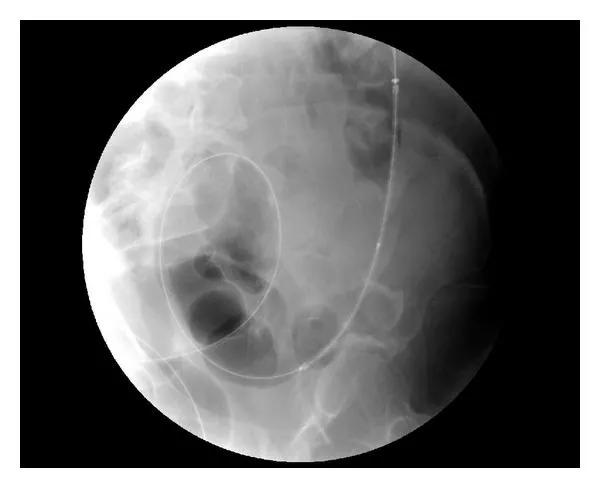
Рис. 8. Стентирование «стент в стент» при врастании опухоли в просвет стента [122].
A. Определяется врастание опухоли в просвет ранее установленного стента (селезеночный угол ободочной кишки).
B. Подтверждение этого при рентгенконтрастном исследовании.
C. Струна-проводник установлена максимально выше через ранее установленный стент.
D. Выполнено стентирование «стент в стент».
В исследовании Lee H.J. с соавторами обструкция стента возникла у 15% пациентов. Во всех случаях удалось выполнить повторное эндоскопическое вмешательство [59].
Использование покрытых стентов позволит уменьшить частоту этого осложнения. При этом в ряде исследований отмечен высокий риск миграции этих стентов и отсутствие существенной разницы в длительности проходимости [75, 76, 78]. Из-за этого рекомендации по применению покрытых и непокрытых стентов противоречивы (табл. 2) [47].
Табл. 2. Рекомендации по использованию покрытых и непокрытых стентов.
|
Предоперационная подготовка |
Проксимальное поражение кишки |
Паллиативный вариант |
Внекишечная обструкция |
Доброкачественные заболевания |
Покрытый vs непокрытый | |
|
ESGE* |
Δ |
Δ |
○ |
Δ |
x |
= |
|
ASGE** |
○ |
Δ |
○ |
Δ |
Δ |
< |
|
KSGE*** |
Δ |
Δ |
○ |
Δ |
Δ |
= |
ESGE — European Society of Gastrointestinal Endoscopy.
ASGE — American Society of Gastrointestinal Endoscopy.
KSGE — Korean Society of Gastrointestinal Endoscopy.
Условные обозначения:
○ рекомендовано
Δ выбор стента зависит от клинической ситуации
x не рекомендовано
> покрытый тип стента предпочтительнее
< непокрытый тип стента предпочтительнее
= эффективность одинаковая
Процент миграции стента зависит от его типа. Частота миграции покрытых стентов выше, чем миграция непокрытых стентов [63, 75, 96, 98, 67, 8, 120, 115]. Choo с соавторами сообщили о 50-процентном уровне миграции с использованием двух покрытых типов стентов у 20 пациентов [18, 2].
На частоту миграции стента оказывают влияние его характеристики. Например, один из факторов, которые могут повлиять на риск миграции стента, — взаимосвязь между характеристиками СРМС и опухолевого поражения. Миграция может произойти, если стент слишком узкий, или если его длина меньше протяженности опухолевого поражения [72], или если на фоне проводимого лечения опухоль изменила размеры. В случае миграции стента при рецидиве кишечной непроходимости возможно повторное стентирование [87].
Незначительные осложнения, к которым относится кровотечение, инконтиненция и болевой синдром, достаточно часто встречаются после стентирования.
Причина кровотечения — повреждение слизистой оболочки или опухоли, которая, как правило, более рыхлая. В большинстве случаев кровотечение останавливается самостоятельно или может потребовать консервативной терапии [87–89]. Инконтиненция возможна при расположении края стента на расстоянии 2 см и менее от ануса [4, 5, 97, 98]. Во избежание подобной ситуации необходимо раскрывать стент выше, чем 2 см от анального канала. Боли и тенезмы могут сопровождать колоректальное стентирование. Принято считать, что локализация края стента до 5 см от анального канала может приводить к развитию болевого синдрома. В ретроспективном исследовании Song H.Y. имеются указания на уменьшение болевого синдрома при коррекции положения стента выше, чем 5 см от анального канала [120–121].
Применение биоразлагаемых стентов при доброкачественных заболеваниях желудочно-кишечного тракта. В связи с недавними достижениями в области материаловедения разрабатываются и исследуются новые материалы для биодеградируемых стентов. В нескольких клинических исследованиях была оценена полезность биодеградируемых стентов при рефрактерных доброкачественных заболеваниях пищевода, включая постожоговый стеноз или стеноз в послеоперационный период [22, 33, 101, 106–108]. Однако эффективность применения этого вида стентов при доброкачественных поражениях желудочно-кишечного тракта остается предметом дискуссии. В одном пилотном рандомизированном контролируемом исследовании о применении биодеградируемых стентов в лечении доброкачественных заболеваний пищевода у группы пациентов, которым был установлен стент, сохранялись явления дисфагии, болевой синдром и другое, что требовало назначения препаратов, по сравнению с группой, при лечении которых использовались стандартные методы (бужирование, баллонная дилатация) [22]. Кроме того, информация об эффективности применения биоразлагаемых стентов при доброкачественных заболеваниях толстой кишки также дискуссионна. Опубликованы только сообщения о редких случаях применения этих стентов [38, 68, 69, 80, 84, 89, 97, 104]. В одном случае биодеградируемый стент применялся при болезни Крона — и рецидив обструктивных симптомов не наблюдался в течение 16 месяцев [90]. В другом случае данный вид стента был установлен трем пациентам с болезнью Крона — нарушений при его использовании не отмечено, просвет кишки был восстановлен [84]. Сомнение у специалистов вызывает тот факт, что радиальная сила стента может снижаться при его разложении. Для дальнейшего клинического использования биоразлагаемых стентов при патологии толстой кишки необходима большая длительность наблюдения за пациентами и адекватные рандомизированные контролируемые исследования.
Стенты с лекарственным покрытием. На сегодняшний день проведено несколько исследований на животных и несколько клинических исследований использования данных стентов. В большинстве публикаций имеются указания на применение этих стентов при билиарном стенозе. По большей части все исследования носили экспериментальный характер [11, 37, 46, 58, 94, 95, 111]. Убедительных данных о высокой эффективности этих стентов у пациентов с патологией толстой кишки нет. В экспериментальном исследовании 2013 года Li G. и соавторов доказана эффективность стентов с 5-фторурацилом для лечения КРР с низкой частотой рестеноза из-за роста опухоли [65]. Непокрытые стенты не могут быть применены в подобных случаях из-за риска врастания опухоли в стент. В будущем при дальнейшем развитии технологий возможно использование данных стентов.
Заключение
В настоящее время колоректальное стентирование с использованием СРМС может проводиться в ходе лечения колоректальных злокачественных препятствий в качестве паллиативной терапии или этапа предоперационной подготовки. СРМС также может применяться при доброкачественных поражениях кишечника, таких как фистулы, доброкачественные стриктуры и сдавление извне.
Хотя эндоскопическое колоректальное стентирование относительно безопасно и имеет низкую частоту осложнений, эндоскопист должен быть знаком с особенностями, материалом, дизайном и характеристиками стентов, чтобы снизить риск осложнений.
Появляются новые конструкции стентов, а показания к их использованию увеличиваются. Для определения дальнейшей эффективности колоректальных стентов необходим всесторонний анализ их использования.
Список литературы:
1. Федоров А.Г., Давыдова С.В., Климов А.Е., Потанина О.В. Восстановление пассажа содержимого толстой кишки при опухолевой непроходимости // Тихоокеан. мед. журн. — 2011. — №4. — С. 10–13.
2. Abbas M.A., Kharabadze G., Ross E.M., Abbass M.A. Predictors of outcome for endoscopic colorectal stenting: a decade experience. Int J Colorectal Dis. 2017. Mar; 32(3): 375–382. DOI: 10.1007/s00384-016-2696-1.
3. Allievi N., Ceresoli M., Fugazzola P., Montori G., Coccolini F., Ansaloni L. Endoscopic Stenting as Bridge to Surgery versus Emergency Resection for Left-Sided Malignant Colorectal Obstruction: An Updated Meta-Analysis. Int J Surg Oncol. 2017; 2017: 2863272. DOI: 10.1155/2017/2863272.
4. Baron T.H., Dean P.A., Yates M.R., Canon C., Koehler R.E. Expandable metal stents for the treatment of colonic obstruction: techniques and outcomes. Gastrointest Endosc. 1998; 47: 277–286.
5. Baron T.H. Colonic stenting: technique, technology, and outcomes for malignant and benign disease. Gastrointest Endosc Clin N Am. 2005; 15: 757–771.
6. Beamish E., Kwok H., Tabard-Cossa V., Godin M. Fine-tuning the size and minimizing the noise of solid-state nanopores. J Vis Exp. 2013; (80): e51081.
7. Branche J., Attar A., Vernier-Massouille G., Bulois P., Colombel J.F., Bouhnik Y., Maunoury V. Extractible self-expandable metal stent in the treatment of Crohn’s disease anastomotic strictures. Endoscopy. 2012; 44. Suppl 2. UCTN: E325–E326.
8. Branger F., Thibaudeau E., Mucci-Hennekinne S., Metivier-Cesbron E., Vychnevskaia K., Hamy A., Arnaud J.P. Management of acute malignant large-bowel obstruction with self-expanding metal stent. Int J Colorectal Dis. 2010; 25: 1481–1485.
9. Brehant O., Fuks D., Bartoli E., Yzet T., Verhaeghe P., Regimbeau J.M. Elective (planned) colectomy in patients with colorectal obstruction after placement of a self-expanding metallic stent as a bridge to surgery: the results of a prospective study. Colorectal Dis. 2009; 11: 178–183.
10. Caceres A., Zhou Q., Iasonos A., Gerdes H., Chi D.S., Barakat R.R. Colorectal stents for palliation of large-bowel obstructions in recurrent gynecologic cancer: an updated series. Gynecol Oncol. 2008; 108: 482–485.
11. Cai X.B., Zhang W.X., Zhang R.L., Dong Yuan X., Yang Q., Qi X.S., Li B.W., Qin Qian Y., Wang X.P., Lu L.G., et al. Safety and efficacy of a novel plastic stent coated with stone-dissolving agents for the treatment of biliary stones in a porcine model. Endoscopy. 2015; 47: 457–461.
12. Carne P.W., Frye J.N., Robertson G.M., Frizelle F.A. Stents or open operation for palliation of colorectal cancer: a retrospective, cohort study of perioperative outcome and long-term survival. Dis Colon Rectum. 2004; 47: 1455–1461.
13. Cennamo V., Fuccio L., Mutri V., Minardi M.E., Eusebi L.H., Ceroni L., Laterza L., Ansaloni L., Pinna A.D., Salfi N., et al. Does stent placement for advanced colon cancer increase the risk of perforation during bevacizumab-based therapy? Clin Gastroenterol Hepatol. 2009; 7: 1174–1176.
14. Chernookov A.I., Karapetyan M.M., Bagdasarov V.V., Bagdasarova Е.A., Kosachenko M.V., Moiseev A.P. Colorectal Stenting for Treatment of Malignant Large Bowel Obstruction. Novosti Khirurgii. 2016. Sep-Oct; Vol 24 (5): 497–507.
15. Cho Y.K., Kim S.W., Lee B.I., Lee K.M., Lim C.H., Kim J.S., Chang J.H., Park J.M., Lee I.S., Choi M.G., et al. Clinical outcome of self-expandable metal stent placement in the management of malignant proximal colon obstruction. Gut Liver. 2011; 5: 165–170.
16. Choi J.H., Lee Y.J., Kim E.S., Choi J.H., Cho K.B., Park K.S., Jang B.K., Chung W.J., Hwang J.S. Covered self-expandable metal stents are more associated with complications in the management of malignant colorectal obstruction. Surg Endosc. 2013; 27: 3220–3227.
17. Choi J.S., Choo S.W., Park K.B., Shin S.W., Yoo S.Y., Kim J.H., Do Y.S. Interventional management of malignant colorectal obstruction: use of covered and uncovered stents. Korean J Radiol. 2007; 8: 57–63.
18. Choo I., Do Y., Suh S., et al. Malignant colorectal obstruction: treatment with a flexible covered stent. Radiology. 1998; 206: 415–421.
19. Datye A., Hersh J. Colonic perforation after stent placement for malignant colorectal obstruction — causes and contributing factors. Minim Invasive Ther Allied Technol. 2011; 20: 133–140.
20. de Gregorio M.A., Mainar A., Rodriguez J., Alfonso E.R., Tejero E., Herrera M., Medrano J., D’Agostino H. Colon stenting: a review. Semin Intervent Radiol. 2004. Sep; 21(3): 205–216. DOI: 10.1055/s-2004-860941.
21. Deans G.T., Krukowski Z.H., Irwin S.T. Malignant obstruction of the left colon. Br J Surg. 1994; 81: 1270–1276.
22. Dhar A., Close H., Viswanath Y.K., Rees C.J., Hancock H.C., Dwarakanath A.D., Maier R.H., Wilson D., Mason J.M. Biodegradable stent or balloon dilatation for benign oesophageal stricture: pilot randomised controlled trial. World J Gastroenterol. 2014; 20: 18199–18206.
23. Donnellan F., Cullen G., Cagney D., O’Halloran P., Harewood G.C., Murray F.E., Patchett S.E. Efficacy and safety of colonic stenting for malignant disease in the elderly. Int J Colorectal Dis. 2010; 25: 747–750.
24. Dronamraju S.S., Ramamurthy S., Kelly S.B., Hayat M. Role of self-expanding metallic stents in the management of malignant obstruction of the proximal colon. Dis Colon Rectum. 2009; 52: 1657–1661.
25. Ersan V., Kutlu R., Erdem C., Karagul S., Kayaalp C. Colorectal Stenting for Obstruction due to Retrorectal Tumor in a Patient Unsuitable for Surgery. J Transl Int Med. 2017. Sep 30; 5(3): 186–188. DOI: 10.1515/jtim-2017-0026.
26. Fernandez-Esparrach G., Bordas J.M., Giraldez M.D., Gines A., Pellise M., Sendino O., Martinez-Palli G., Castells A., Llach J. Severe complications limit long-term clinical success of self-expanding metal stents in patients with obstructive colorectal cancer. Am J Gastroenterol. 2010; 105: 1087–1093.
27. Fregonese D., Naspetti R., Ferrer S., Gallego J., Costamagna G., Dumas R., Campaioli M., Morante A.L., Mambrini P., Meisner S., et al. Ultraflex precision colonic stent placement as a bridge to surgery in patients with malignant colon obstruction. Gastrointest Endosc. 2008; 67: 68–73.
28. Gallo G., Sammarco G., Chiriatti A.P., Calabria F., Sacco R. The role of self-expandable metallic stents as "bridge to surgery" for the treatment of acute malignant colorectal obstruction. Our experience. Ann Ital Chir. 2017; 6: 418–424.
29. Garcea G., Sutton C.D., Lloyd T.D., Jameson J., Scott A., Kelly M.J. Management of benign rectal strictures: a review of present therapeutic procedures. Dis Colon Rectum. 2003; 46: 1451–1460.
30. Geiger T.M., Miedema B.W., Tsereteli Z., Sporn E., Thaler K. Stent placement for benign colonic stenosis: case report, review of the literature, and animal pilot data. Int J Colorectal Dis. 2008; 23: 1007–1012.
31. Geraghty J., Sarkar S., Cox T., Lal S., Willert R., Ramesh J., Bodger K., Carlson G.L. Management of large bowel obstruction with self-expanding metal stents. A multicentre retrospective study of factors determining outcome. Colorectal Dis. 2014; 16: 476–483.
32. Gorissen K.J., Tuynman J.B., Fryer E., Wang L., Uberoi R., Jones O.M., Cunningham C., Lindsey I. Local recurrence after stenting for obstructing left-sided colonic cancer. Br J Surg. 2013; 100: 1805–1809.
33. Griffiths E.A., Gregory C.J., Pursnani K.G., Ward J.B., Stockwell R.C. The use of biodegradable (SX-ELLA) oesophageal stents to treat dysphagia due to benign and malignant oesophageal disease. Surg Endosc. 2012; 26: 2367–2375.
34. Guan Y.S., Sun L., Li X., Zheng X.H. Successful management of a benign anastomotic colonic stricture with self-expanding metallic stents: a case report. World J Gastroenterol. 2004; 10: 3534–3536.
35. Han S.H., Lee J.H. Colonic stent-related complications and their management. Clin Endosc. 2014. Sep; 47 (5): 415–419. DOI: 10.5946/ce.2014.47.5.415.
36. Han Y.M., Lee J.M., Lee T.H. Delayed colon perforation after palliative treatment for rectal carcinoma with bare rectal stent: a case report. Korean J Radiol. 2000; 1:.169–171.
37. Jang S.I., Kim J.H., Kim M., Yang S., Jo E.A., Lee J.W., Na K., Kim J.M., Jeong S., Lee D.H., et al. Porcine feasibility and safety study of a new paclitaxel-eluting biliary stent with a Pluronic-containing membrane. Endoscopy. 2012; 44: 825–831.
38. Janik V., Horak L., Hnanicek J., Malek J., Laasch H.U. Biodegradable polydioxanone stents: a new option for therapy-resistant anastomotic strictures of the colon. Eur Radiol. 2011; 21: 1956–1961.
39. Garcia-Cano J. Colorectal stenting as first-line treatment in acute colonic obstruction World J Gastrointest Endosc. 2013. Oct 16; 5 (10): 495–501.
40. Jung M.K., Park S.Y., Jeon S.W., Cho C.M., Tak W.Y., Kweon Y.O., Kim S.K., Choi Y.H., Kim G.C., Ryeom H.K. Factors associated with the long-term outcome of a self-expandable colon stent used for palliation of malignant colorectal obstruction. Surg Endosc. 2010; 24: 525–530.
41. Kang S.G., Jung G.S., Cho S.G., Kim J.G., Oh J.H., Song H.Y., Kim E.S. The efficacy of metallic stent placement in the treatment of colorectal obstruction. Korean J Radiol. 2002; 3: 79–86.
42. Karoui M., Charachon A., Delbaldo C., Loriau J., Laurent A., Sobhani I., Tran Van Nhieu J., Delchier J.C., Fagniez P.L., Piedbois P., et al. Stents for palliation of obstructive metastatic colon cancer: impact on management and chemotherapy administration. Arch Surg. 2007; 142: 619–623.
43. Karstensen J.G., Vilmann P., Hendel J. Successful endoscopic treatment of a 12-cm small-bowel Crohn stricture with a custom-made biodegradable stent. Endoscopy. 2014; 46. Suppl 1. UCTN: E227–E228.
44. Keranen I., Lepisto A., Udd M., Halttunen J., Kylanpaa L. Outcome of patients after endoluminal stent placement for benign colorectal obstruction. Scand J Gastroenterol. 2010; 45: 725–731.
45. Keswani R.N., Azar R.R., Edmundowicz S.A., Zhang Q., Ammar T., Banerjee B., Early D.S., Jonnalagadda S.S. Stenting for malignant colonic obstruction: a comparison of efficacy and complications in colonic versus extracolonic malignancy. Gastrointest Endosc. 2009; 69: 675–680.
46. Kim do H., Jeong Y.I., Chung C.W., Kim C.H., Kwak T.W., Lee H.M., Kang D.H. Preclinical evaluation of sorafenib-eluting stent for suppression of human cholangiocarcinoma cells. Int J Nanomedicine. 2013; 8: 1697–1711.
47. Kim E.J., Kim Y.J. Stents for colorectal obstruction: Past, present, and future. World J Gastroenterol. 2016. Jan 14; 22 (2): 842–852. DOI: 10.3748/wjg.v22.i2.842.
48. Kim J.H., Kim K.R., Shin J.H., Kim H.C., Yu C.S., Kim J.C. Malignant rectal obstruction within 5 cm of the anal verge: is there a role for expandable metallic stent placement? Gastrointest Endosc. 2008; 68: 713–720
49. Kim J.H., Kim Y.J., Lee J.J., Chung J.W., Kwon K.A., Park D.K., Kim J.H., Hahm K.B. The efficacy of self-expanding metal stents for colorectal obstruction with unresectable stage IVB colorectal cancer. Hepatogastroenterology. 2012; 59: 2472–2476.
50. Kim J.H., Ku Y.S., Jeon T.J., Park J.Y., Chung J.W., Kwon K.A., Park D.K., Kim Y.J., Kim J.H., Lee J.J., Cho J.H., Kim K.O., Chung J.W., Kim Y.J., Kwon K.A., Park D.K., Kim J.H. Endoscopic stenting for recurrence-related colorectal anastomotic site obstruction: preliminary experience. World J Gastroenterol. 2014; 20: 13936–13941.
51. Kim J.H., Song H.Y., Li Y.D., Shin J.H., Park J.H., Yu C.S., Kim J.C. Dual-design expandable colorectal stent for malignant colorectal obstruction: comparison of flared ends and bent ends. AJR Am J Roentgenol. 2009; 193: 248–254.
52. Kim J.H., Song H.Y., Park J.H., Ye B.D., Yoon Y.S., Kim J.C. Metallic stent placement in the palliative treatment of malignant colonic obstructions: primary colonic versus extracolonic malignancies. J Vasc Interv Radiol. 2011; 22: 1727–1732.
53. Kim J.Y., Kim S.G., Im J.P., Kim J.S., Jung H.C. Comparison of treatment outcomes of endoscopic stenting for colonic and extracolonic malignant obstruction. Surg Endosc. 2013; 27: 272–277.
54. Kobayashi H., Mochizuki H., Sugihara K., Morita T., Kotake K., Teramoto T., Kameoka S., Saito Y., Takahashi K., Hase K., et al. Characteristics of recurrence and surveillance tools after curative resection for colorectal cancer: a multicenter study. Surgery. 2007; 141: 67–75.
55. Kwon Y.H., Jeon S.W., Lee Y.K. Endoscopic management of refractory benign colorectal strictures. Clin Endosc. 2013; 46: 472–475.
56. Latenstein A.E.J., Hendriks M.P., van Halsema E.E., van Hooft J.E., van Berkel A.M. Long-Term Colon Stent Patency for Obstructing Colorectal Cancer Combined with Bevacizumab. Case Rep Gastroenterol. 2017. Nov 29; 11 (3): 711–717. DOI: 10.1159/000481933.
57. Law W.L., Choi H.K., Chu K.W. Comparison of stenting with emergency surgery as palliative treatment for obstructing primary left-sided colorectal cancer. Br J Surg. 2003; 90: 1429–1433.
58. Lee D.H., Kang S.G., Jeong S., Yoon C.J., Choi J.A., Byun J.N., Park J.H., Lee K.B. Local delivery system of immune modulating drug for unresectable adenocarcinoma: in vitro experimental study and in vivo animal study. Cardiovasc Intervent Radiol. 2006; 29: 832–837.
59. Lee H.J., Hong S.P., Cheon J.H., Kim T.I., Min B.S., Kim N.K., Kim W.H. Long-term outcome of palliative therapy for malignant colorectal obstruction in patients with unresectable metastatic colorectal cancers: endoscopic stenting versus surgery. Gastrointest Endosc. 2011; 73: 535–542.
60. Lee J.M., Byeon J.S. Colorectal Stents: Current Status. Clin Endosc. 2015. May; 48 (3): 194–200. DOI: 10.5946/ce.2015.48.3.194.
61. Lee J.W., Yang S.G., Na K. Gemcitabine-releasing polymeric films for covered self-expandable metallic stent in treatment of gastrointestinal cancer. Int J Pharm. 2012; 427: 276–283.
62. Lee K.J., Kim S.W., Kim T.I., Lee J.H., Lee B.I., Keum B., et al. Evidence-based recommendations on colorectal stenting: a report from the stent study group of the Korean Society of Gastrointestinal Endoscopy. Clin Endosc. 2013. Jul; 46 (4): 355–67. DOI: 10.5946/ce.2013.46.4.355.
63. Lee K.M., Shin S.J., Hwang J.C., Cheong J.Y., Yoo B.M., Lee K.J., Hahm K.B., Kim J.H., Cho S.W. Comparison of uncovered stent with covered stent for treatment of malignant colorectal obstruction. Gastrointest Endosc. 2007; 66: 931–936.
64. Levine R.A., Wasvary H., Kadro O. Endoprosthetic management of refractory ileocolonic anastomotic strictures after resection for Crohn’s disease: report of nine-year follow-up and review of the literature. Inflamm Bowel Dis. 2012; 18: 506–512.
65. Li G., Chen Y., Hu J., Wu X., Hu J., He X., Li J., Zhao Z., Chen Z., Li Y., et al. A 5-fluorouracil-loaded polydioxanone weft-knitted stent for the treatment of colorectal cancer. Biomaterials. 2013; 34: 9451–9461.
66. Liberman H., Adams D.R., Blatchford G.J., Ternent C.A., Christensen M.A., Thorson A.G. Clinical use of the self-expanding metallic stent in the management of colorectal cancer. Am J Surg. 2000; 180: 407–411; discussion 412.
67. Lopera J.E., de Gregorio M.A. Fluoroscopic management of complications after colorectal stent placement. Gut Liver. 2010; 4. Suppl 1: S9–S18.
68. Lorenzo-Zuniga V., Moreno-de-Vega V., Marin I., Boix J. Biodegradable stents in gastrointestinal endoscopy. World J Gastroenterol. 2014; 20: 2212–2217.
69. Luchtefeld M.A., Milsom J.W., Senagore A., Surrell J.A., Mazier W.P. Colorectal anastomotic stenosis. Results of a survey of the ASCRS membership. Dis Colon Rectum. 1989; 32: 733–736.
70. Luigiano C., Ferrara F., Fabbri C., Ghersi S., Bassi M., Billi P., Polifemo A.M., Landi P., Cennamo V., Consolo P., et al. Through-the-scope large diameter self-expanding metal stent placement as a safe and effective technique for palliation of malignant colorectal obstruction: a single center experience with a long-term follow-up. Scand J Gastroenterol. 2011; 46: 591–596.
71. Manes G., de Bellis M., Fuccio L., Repici A., Masci E., Ardizzone S., et al. Endoscopic palliation in patients with incurable malignant colorectal obstruction by means of self-expanding metal stent: analysis of results and predictors of outcomes in a large multicenter series. Arch Surg. 2011. Oct; 146 (10): 1157–1162. DOI: 10.1001/archsurg.2011.233.
72. Mauro M.A., Koehler R.E., Baron T.H. Advances in gastrointestinal intervention: the treatment of gastroduodenal and colorectal obstructions with metallic stents. Radiology. 2000; 215: 659–669.
73. McLoughlin M.T., Byrne M.F. Endoscopic stenting: where are we now and where can we go? World J Gastroenterol. 2008; 14: 3798–3803.
74. Miyayama S., Matsui O., Kifune K., Yamashiro M., Yamamoto T., Kitagawa K., Kasahara Y., Asada Y., Iida Y., Miura S. Malignant colonic obstruction due to extrinsic tumor: palliative treatment with a self-expanding nitinol stent. AJR Am J Roentgenol. 2000; 175: 1631–1637.
75. Moon C.M., Kim T.I., Lee M.S., Ko B.M., Kim H.S., Lee K.M., Byeon J.S., Kim Y.S. Comparison of a newly designed double-layered combination covered stent and D-weave uncovered stent for decompression of obstructive colorectal cancer: a prospective multicenter study. Dis Colon Rectum. 2010; 53: 1190–1196.
76. Park J.J., Rhee K, Yoon JY, Park SJ, Kim JH, Kim JH, Youn YH, Kim TI, Park H, Kim WH, Cheon JH. Impact of peritoneal carcinomatosis on clinical outcomes of patients receiving self-expandable metal stents for malignant colorectal obstruction Endoscopy. 2018. Aug 31. DOI: 10.1055/a-0657-3764.
77. Park J.K., Lee M.S., Ko B.M., Kim H.K., Kim Y.J., Choi H.J., Hong S.J., Ryu C.B., Moon J.H., Kim J.O., et al. Outcome of palliative self-expanding metal stent placement in malignant colorectal obstruction according to stent type and manufacturer. Surg Endosc. 2011; 25: 1293–1299.
78. Park S., Cheon J.H., Park J.J., Moon C.M., Hong S.P., Lee S.K., Kim T.I., Kim W.H. Comparison of efficacies between stents for malignant colorectal obstruction: a randomized, prospective study. Gastrointest Endosc. 2010; 72: 304–310.
79. Paul L., Pinto I., Gomez H., Fernandez-Lobato R., Moyano E. Metallic stents in the treatment of benign diseases of the colon: preliminary experience in 10 cases. Radiology. 2002; 223: 715–722.
80. Perez Roldan F., Gonzalez Carro P., Villafanez Garcia M.C., Aoufi Rabih S., Legaz Huidobro M.L., Sanchez-Manjavacas Munoz N., Roncero Garcia-Escribano O., Ynfante Ferrus M., Bernardos Martin E., Ruiz Carrillo F. Usefulness of biodegradable polydioxanone stents in the treatment of postsurgical colorectal strictures and fistulas. Endoscopy. 2012; 44: 297–300.
81. Phillips R.K., Hittinger R., Fry J.S., Fielding L.P. Malignant large bowel obstruction. Br J Surg. 1985; 72: 296–302.
82. Pirlet I.A., Slim K., Kwiatkowski F., Michot F., Millat B.L. Emergency preoperative stenting versus surgery for acute left-sided malignant colonic obstruction: a multicenter randomized controlled trial. Surg Endosc. 2011; 25: 1814–1821.
83. Ptok H., Marusch F., Steinert R., Meyer L., Lippert H., Gastinger I. Incurable stenosing colorectal carcinoma: endoscopic stent implantation or palliative surgery? World J Surg. 2006; 30: 1481–1487.
84. Rejchrt S., Kopacova M., Brozik J., Bures J. Biodegradable stents for the treatment of benign stenoses of the small and large intestines. Endoscopy. 2011; 43: 911–917.
85. Repici A., Adler D.G., Gibbs C.M., Malesci A., Preatoni P., Baron T.H. Stenting of the proximal colon in patients with malignant large bowel obstruction: techniques and outcomes. Gastrointest Endosc. 2007; 66: 940–944.
86. Repici A., De Caro G., Luigiano C., Fabbri C., Pagano N., Preatoni P., Danese S., Fuccio L., Consolo P., Malesci A., et al. WallFlex colonic stent placement for management of malignant colonic obstruction: a prospective study at two centers. Gastrointest Endosc. 2008; 67: 77–84.
87. Repici A., de Paula Pessoa Ferreira D. Expandable metal stents for malignant colorectal strictures. Gastrointest Endosc Clin N Am. 2011; 21: 511–533.
88. Repici A., Fregonese D., Costamagna G., Dumas R., Kähler G., Meisner S., Giovannini M., Freeman J., Petruziello L., Hervoso C., et al. Ultraflex precision colonic stent placement for palliation of malignant colonic obstruction: a prospective multicenter study. Gastrointest Endosc. 2007; 66: 920–927.
89. Repici A., Pagano N., Rando G., Carlino A., Vitetta E., Ferrara E., Strangio G., Zullo A., Hassan C. A retrospective analysis of early and late outcome of biodegradable stent placement in the management of refractory anastomotic colorectal strictures. Surg Endosc. 2013; 27: 2487–2491.
90. Rodrigues C., Oliveira A., Santos L., Pires E., Deus J. Biodegradable stent for the treatment of a colonic stricture in Crohn’s disease. World J Gastrointest Endosc. 2013; 5: 265–269.
91. Sagar J. Colorectal stents for the management of malignant colonic obstructions. Cochrane Database Syst Rev. 2011; 11: CD007378.
92. Sebastian S., Johnston S., Geoghegan T., Torreggiani W., Buckley M. Pooled analysis of the efficacy and safety of self-expanding metal stenting in malignant colorectal obstruction. Am J Gastroenterol. 2004 Oct; 99 (10): 2051–2057.
93. Selinger C.P., Ramesh J., Martin D.F. Long-term success of colonic stent insertion is influenced by indication but not by length of stent or site of obstruction. Int J Colorectal Dis. 2011; 26: 215–218.
94. Shi J., Lv Y., Yu L., Zhang B., Zhang X., Fan C., Geng Z. Interest of a new biodegradable stent coated with paclitaxel on anastomotic wound healing after biliary reconstruction. Eur J Gastroenterol Hepatol. 2013; 25: 1415–1423.
95. Shin S.J., Kim T.I., Kim B.C., Lee Y.C., Song S.Y., Kim W.H. Clinical application of self-expandable metallic stent for treatment of colorectal obstruction caused by extrinsic invasive tumors. Dis Colon Rectum. 2008; 51: 578–583.
96. Small A.J., Baron T.H. Comparison of Wallstent and Ultraflex stents for palliation of malignant left-sided colon obstruction: a retrospective, case-matched analysis. Gastrointest Endosc. 2008; 67: 478–488.
97. Small A.J., Coelho-Prabhu N., Baron T.H. Endoscopic placement of self-expandable metal stents for malignant colonic obstruction: long-term outcomes and complication factors. Gastrointest Endosc. 2010; 71: 560–572.
98. Small A.J., Young-Fadok T.M., Baron T.H. Expandable metal stent placement for benign colorectal obstruction: outcomes for 23 cases. Surg Endosc. 2008; 22: 454–462.
99. Suh J.P., Kim S.W., Cho Y.K., Park J.M., Lee I.S., Choi M.G., Chung I.S., Kim H.J., Kang W.K., Oh S.T. Effectiveness of stent placement for palliative treatment in malignant colorectal obstruction and predictive factors for stent occlusion. Surg Endosc. 2010; 24: 400–406.
100. Tan C.J., Dasari B.V., Gardiner K. Systematic review and meta-analysis of randomized clinical trials of self-expanding metallic stents as a bridge to surgery versus emergency surgery for malignant left-sided large bowel obstruction. Br J Surg. 2012; 99: 469–476.
102. Tilney H.S., Lovegrove R.E., Purkayastha S., Sains P.S., Weston-Petrides G.K., Darzi A.W., Tekkis P.P., Heriot A.G. Comparison of colonic stenting and open surgery for malignant large bowel obstruction. Surg Endosc. 2007; 21: 225–233.
103. Tomita M., Saito S., Makimoto S., Yoshida S., Isayama H., Yamada T., Matsuzawa T., Enomoto T., Kyo R., Kuwai T., Hirata N., Shimada M., Hirakawa T., Koizumi K., Saida Y. Self-expandable metallic stenting as a bridge to surgery for malignant colorectal obstruction: pooled analysis of 426 patients from two prospective multicenter series. Surg Endosc. 2018. Jul 13. DOI: 10.1007/s00464-018-6324-8.
104. Toth E., Nielsen J., Nemeth A., Wurm Johansson G., Syk I., Mangell P., Almqvist P., Thorlacius H. Treatment of a benign colorectal anastomotic stricture with a biodegradable stent. Endoscopy. 2011; 43. Suppl 2. UCTN: E252–E253.
105. Trompetas V., Saunders M., Gossage J., Anderson H. Shortcomings in colonic stenting to palliate large bowel obstruction from extracolonic malignancies. Int J Colorectal Dis. 2010; 25: 851–854.
106. van Hooft J.E., van Berge Henegouwen M.I., Rauws E.A., Bergman J.J., Busch O.R., Fockens P. Endoscopic treatment of benign anastomotic esophagogastric strictures with a biodegradable stent. Gastrointest Endosc. 2011; 73: 1043–1047.
107. van Hooft J.E., van Halsema E.E., Vanbiervliet G., Beets-Tan R.G.H., DeWitt J.M., Donnellan F., et al. Self-expandable metal stents for obstructing colonic and extracolonic cancer: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Gastrointest Endosc. 2014. Nov; 80 (5): 747–761. DOI: 10.1016/j.gie.2014.09.018.
108. Vandenplas Y., Hauser B., Devreker T., Urbain D., Reynaert H. A degradable esophageal stent in the treatment of a corrosive esophageal stenosis in a child. Endoscopy. 2009; 41. Suppl 2: E73.
109. Wang X., He J., Chen X., Yang Q. Stenting as a bridge to resection versus emergency surgery for left-sided colorectal cancer with malignant obstruction: A systematic review and meta-analysis. Int J Surg. 2017. Dec; 48: 64–68. DOI: 10.1016/j.ijsu.2017.10.004.
110. Wang Y., Cai X., Cai H., Liang Y., Huang D., Liang X. Experimental study of colonic anastomosis with a degradable stent in a porcine model. Am J Surg. 2010; 199: 833–839.
111. Wang Y., Cai X., Mei J., Liu K., Cai X. Colonic anastomosis with a doxycycline-coated stent: an experimental study in a porcine model. Dig Surg. 2014; 31: 87–94.
112. Watt A.M., Faragher I.G., Griffin T.T., Rieger N.A., Maddern G.J. Self-expanding metallic stents for relieving malignant colorectal obstruction: a systematic review. Ann Surg. 2007; 246: 24–30.
113. Weinstock L.B., Shatz B.A. Endoscopic abnormalities of the anastomosis following resection of colonic neoplasm. Gastrointest Endosc. 1994; 40: 558–561.
114. Williams D., Law R., Pullyblank A.M. Colorectal Stenting in Malignant Large Bowel Obstruction: The Learning Curve Int J of Surg Oncol. Vol. 2011. http://dx.doi.org/10.1155/2011/917848.
115. Yang Z., Wu Q., Wang F., Ye X., Qi X., Fan D. A systematic review and meta-analysis of randomized trials and prospective studies comparing covered and bare self-expandable metal stents for the treatment of malignant obstruction in the digestive tract. Int J Med Sci. 2013. Apr 27; 10 (7): 825–835. DOI: 10.7150/ijms.5969.
116. Yao L.Q., Zhong Y.S., Xu M.D., Xu J.M., Zhou P.H., Cai X.L. Self-expanding metallic stents drainage for acute proximal colon obstruction. World J Gastroenterol. 2011; 17: 3342–3346.
117. Ye G.Y., Cui Z., Chen L., Zhong M. Colonic stenting vs emergent surgery for acute left-sided malignant colonic obstruction: a systematic review and meta-analysis. World J Gastroenterol. 2012; 18: 5608–5615.
118. Yoon J.Y., Jung Y.S., Hong S.P., Kim T.I., Kim W.H., Cheon J.H. Clinical outcomes and risk factors for technical and clinical failures of self-expandable metal stent insertion for malignant colorectal obstruction. Gastrointest Endosc. 2011; 74: 858–868.
119. Yoon J.Y., Park S.J., Hong S.P., Kim T.I., Kim W.H., Cheon J.H. Outcomes of secondary self-expandable metal stents versus surgery after delayed initial palliative stent failure in malignant colorectal obstruction. Digestion. 2013; 88: 46–55.
120. Zhang Y., Shi J., Shi B., Song C.Y., Xie W.F., Chen Y.X. Comparison of efficacy between uncovered and covered self-expanding metallic stents in malignant large bowel obstruction: a systematic review and meta-analysis. Colorectal Dis. 2012; 14: e367–e374.
121. Zhang Y., Shi J., Shi B., Song C.Y., Xie W.F., Chen Y.X. Self-expanding metallic stent as a bridge to surgery versus emergency surgery for obstructive colorectal cancer: a meta-analysis. Surg Endosc. 2012; 26: 110–119.
122. Hong S.P. and Kim T.I. Colorectal stenting: An advanced approach to malignant colorectal obstruction. World J Gastroenterol. 2014. Nov 21; 20 (43): 16020–16028.
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.















.jpg)




.png)

















Комментарии