Полный текст статьи:
Парижская классификация опухолевых поражений
В предлагаемом фрагменте Парижской эндоскопической классификации (перевод Ефимовой Е.И.), представлены основные положения, терминология, формулировки и принципы эндоскопической диагностики поверхностных эпителиальных опухолей желудочно-кишечного тракта.
В 2002 году в Париже прошел рабочий семинар международной группы эндоскопистов, хирургов, и патологоанатомов по изучению клинической значимости и пользы японской эндоскопической классификации поверхностных опухолевых поражений желудочно-кишечного тракта.
В пищеводе, желудке и толстой кишке опухолевые поражения предложено называть «поверхностными» при эндоскопическом выявлении ранних раков или неинвазивных опухолевых поражений (дисплазия/ аденома).
При инвазивных поражениях «поверхностной» опухоли соответствует стадия T1 TNM классификации, в которой инвазия ограничена СО и подслизистым слоем.
«Поверхностные» опухоли не вызывают обструкции органа, как правило, протекают бессимптомно, и часто обнаруживаются случайно или при проведении скрининга.
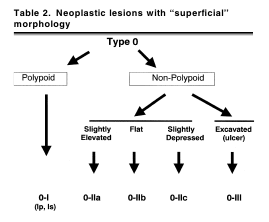
В Японии опухолевые поражения желудка, имеющие эндоскопический внешний вид «поверхностных», классифицируются как подтип «типа 0». Термин «тип 0» был выбран для выделения классификации «поверхностных» поражений из классификации Borrmann, предложенной в 1926 году для «прогрессирующих» опухолей желудка (включает типы 1–4).
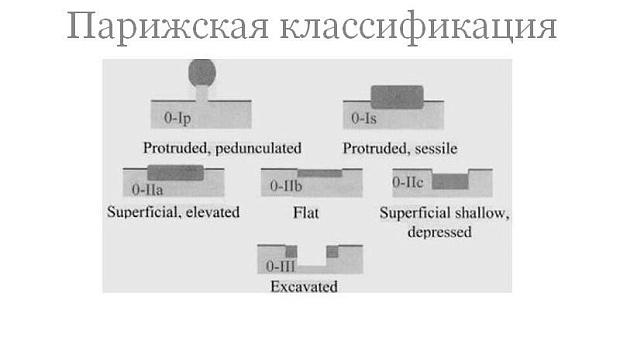
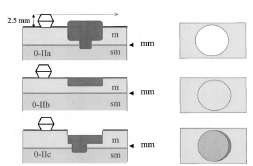
В типе 0 различают полиповидный и неполиповидный подтипы (рис. 1):
Неполиповидный подтип включает поражения
- с небольшими изменениями поверхности (слегка приподнятые (0-IIa), плоские (0-IIb), слегка вдавленные – углубленные (0-IIc)) и
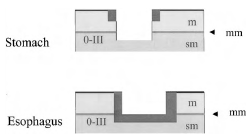
- подрытые (язвенные) поражения (0-III).
Японская ассоциация рака желудка (JGCA) также добавила тип 5 для неклассифицируемых прогрессирующих опухолей.
В итоге полная модификация эндоскопической классификации для опухоли желудка выглядит следующим образом:
- тип 0 – поверхностные полиповидные, плоские/углубленные или подрытые опухоли;
- тип 1 – полиповидный рак, как правило, на широком основании;
- тип 2 – язвенная форма рака с четкими границами и приподнятыми краями;
- тип 3 – язвенно-инфильтративная форма рака без определенных границ;
- тип 4 – неязвенная, диффузная инфильтративная форма рака;
- тип 5 – неклассифицируемый прогрессирующий рак.
Таким образом, макроскопические формы РЖ делятся в классификации JGCA на 6 типов (0-5). Тип 0 с подтипами адаптирован для эндоскопической картины неинвазивных неоплазий и раков, которые могут быть подтверждены морфологически.
Классификация «поверхностных» неоплазий желудка была адаптирована к опухолям пищевода, а позже, когда частота колоректального рака в Японии увеличилась, и для опухолей толстой кишки.
Многие эндоскописты, особенно на Западе, считают японскую классификацию с ее делением для пищевода, желудка и толстой кишки, «ботаническим хобби», слишком сложной для практического применения. Западные эндоскописты основой для принятия решения о лечении считают размер и расположение опухоли, а также гистологическое исследование биопсийного материала.
Тем не менее, японские эндоскописты установили, что данная классификация может быть определяющим фактором в возможности применения эндоскопического лечения.
Для оценки глубины инвазии опухолевого поражения при эндоскопии и выборе тактики дальнейшего лечения может быть использована EUS, а для получения большого образца ткани – EMR. У пациентов с повышенным операционным риском EMR может быть первичным лечением, дополненным по мере необходимости другими методами абляции, такими как электрокоагуляция или фотодинамическая терапия.
Скептицизм в отношении эндоскопической классификации поверхностных неопластических образований поддерживался и различиями в восточной и западной классификациях внутрислизистых поражений. Последняя Венская классификация в некоторой степени разрешила эти различия в использовании терминов «дисплазия», «аденома», «ранний рак» и «распространенный рак». Обратная связь с гистологическими исследованиями имеет решающее значение для развития эндоскопической диагностики в Японии и помогает в непрерывном усовершенствовании эндоскопического исследования.
В отличие от японских специалистов, западным эндоскопистам, как правило, не хватает внимания к деталям в полученной эндоскопической картинке и описании поверхностных поражений. Западные эндоскописты иногда недооценивают значимость и в недостаточной степени используют уточняющие эндоскопические методы, которое могут иметь большое значение в оценке глубины инвазии и принятии решения о методе лечения.
Отличия восточной и западной точки зрения на важность эндоскопического описания возникли во второй половине ХХ века. В Японии высокая частота рака желудка поддерживается его ранним выявлением эндоскопически и двойным контрастным рентгенологическим исследованием. Поскольку плоские образования играют почти исключительную роль в желудочном канцерогенезе, раннее эндоскопическое выявление их нуждается в повышенном внимании и тщательности выполнения эндоскопической процедуры. Дополнительные методы, такие как хромоэндоскопия и увеличение, также были разработаны как вспомогательные для выявления мельчайших поражений.
В Японии подход к ранней диагностике опухолевых поражений пищевода и толстой кишки продолжают по аналогии с желудочным раком. В то время когда японцы были сосредоточены на РЖ, во многих других странах приоритетной была канцер-превенция колоректального рака. И здесь полиповидные образования играют гораздо большую роль в последовательности «полип – рак», установленной Muto, Bussey и Morson в 1975г. Хромоскопия реже используется для полиповидных поражений и детальный эндоскопический анализ внешнего вида полипов менее информативен для прогноза злокачественной инвазии, чем грубая оценка размера или расширения ножки. Таким образом, рутинная хромоэндоскопия при колоноскопии, проводимая для обнаружения аденом, часто считается на Западе малоинформативной. Следовательно, малые неполиповидные (плоские) аденомы (неинвазивная неоплазия) или даже рак могут остаться незамеченными.
В настоящее время точки зрения Востока и Запада сблизились.
Азиатские, европейские и американские патологи внесли предложение о согласительной гистопатологической классификации в трех основных группах внутрислизистых неоплазий:
- неинвазивная низкой степени,
- неинвазивная высокой степени и
- рак с инвазией в собственную пластинку.
Этот консенсус, принятый в Вене, был опубликован в последнем дополнении эндоскопии ЖКТ. Слияние эндоскопической и патологической терминологии позволит использовать преимущества каждой из них. Венская классификация, адаптированная (в частности) к последней классификации распространенных опухолей ВОЗ, была несколько изменена, с улучшенными согласованными оценками и терапевтической значимостью.
ТЕРМИНЫ И ФОРМУЛИРОВКИ
Поверхностные неоплазии при эндоскопии.
Опухолевые поражения называются поверхностными, если по их внешнему виду мы можем предполагать, что инвазия в стенку органа распространяется не глубже подслизистого слоя и нет инфильтрации мышечного слоя.
«Поверхностные»' неоплазии включают опухолевые поражения без инвазии в собственную пластинку и рак с инвазией в собственную пластинку, ограничивающейся СО (желудок и пищевод) или в подслизистую оболочку (толстая кишка).
Термин «ранний рак» предполагает локализованные опухоли с потенциальной возможностью полного излечения после резекции и низкий риск метастазирования в лимфоузлы.
Неопухолевые поражения толстокишечного эпителия (ювенильные или гиперпластические полипы) также относятся к «поверхностным».
Гиперпластические полипы практически не имеют потенциала для перехода в неопластическое поражение, но зубчатые аденомы являются исключением среди неинвазивных опухолевых поражений, сочетая в себе опухолевые клетки с зубчатой структурой.
В пищеводе неоплазии развиваются в многослойном плоском эпителии или в метаплазированном цилиндрическом эпителии (пищевод Барретта, эктопированные участки железистой СО). Дистальнее пищевода неоплазия развивается в железистой СО желудка. Разделяют опухоли, расположенные в кардии, и опухоли дистальнее кардии (субкардиальные опухоли). Опухоли области пищеводно-желудочного перехода включают аденокарциномы дистальной части пищевода и кардии.
Полиповидные и неполиповидные опухолевые поражения.
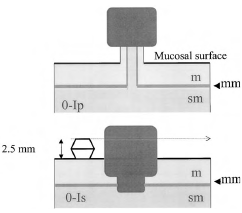
Полиповидные опухолевые поражения при эндоскопии выступают над окружающей поверхностью (см. рис. 1). На операционном материале высота образования в два и более раза превышает толщину окружающей СО. У полипов на ножке основание узкое, у сидячих полипов основание и верхушка имеют одинаковый размер (рис. 2).
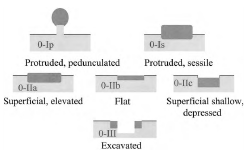
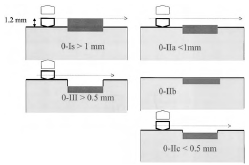
Рисунок 1. Варианты типа 0 опухолевых поражений ЖКТ: полиповидные (Ip и Is), неполиповидные (IIa, IIb и IIc) и подрытые (III).
Рисунок 2. Тип 0-I: на ножке (Ip) или сидячие (Is) в поперечном сечении.
Невыступающие, или неполиповидные опухолевые поражения включают язвы и так называемые плоские поражения. В последнем случае поражения находятся на одном уровне с окружающей СО, либо слегка приподняты или углублены (депрессированы) (рис. 3).
Рисунок 3. Тип 0-II приподнятый (IIa), абсолютно плоский (IIb), углубленный (IIc).
При эндоскопии слегка приподнятое поражение иногда неправильно классифицируется как сидячее (полиповидный подтип). Это различие выявляется при исследовании операционного материала, в котором можно сравнить высоту образования с толщиной нормальной СО. Некоторые приподнятые поражения могут достигать большого (> 10 мм) диаметра без увеличения их высоты или протрузии над СО. В случае углубленных поражений толщина СО в зоне поражения меньше, чем у окружающей СО. Приподнятые поражения могут иметь центральное углубление. Когда есть незначительное углубление в верхней части приподнятого поражения, которое все же выше, чем окружающая нормальная СО, углубленная часть поражения называется «относительным углублением».
Метаплазия – трансформация эпителия одного типа в эпителий другого типа с отличными морфологическими и функциональными характеристиками.
Кишечная метаплазия в пищеводе и желудке классифицируется как полная (тип I) или неполная (тип II или III).
- Кишечная метаплазия I типа в основном состоит из поглощающих клеток с четко определенными ворсинчатыми границами, некоторого количества бокаловидных клеток, а иногда клеток Панета.
- Для кишечной метаплазии II и III типа характерны цилиндрические промежуточные клетки и бокаловидные клетки, которые выделяют сиаломуцин (тип II) или сульфомуцин (тип III).
В дистальном отделе пищевода метаплазия включает три различных типа эпителия, распространенного мозаично:
кардиальный или переходный тип эпителия, где железы состоят почти полностью из слизеобразующих клеток, кислотопродуцирующего типа эпителия, где преобладают париетальные и главные клетки, и кишечного типа эпителия, который часто называют «специализированной кишечной метаплазией».
В желудке кишечная метаплазия ассоциирована с хроническим гастритом и хеликобактерной инфекцией. В обоих случаях также может быть панкреатическая метаплазия.
Аденома и дисплазия.
В западных странах неинвазивные опухоли и доброкачественные поражения цилиндрического эпителия называются «аденома» при выступающих (полиповидных) поражениях и «дисплазия» при плоских или углубленных поражениях (неполиповидных), хотя термины «плоская аденома» и «углубленная аденома» общеприняты и применимы в большинстве случаев и для дискретных поражений. Неоплазии низкой или высокой степени без инвазии в собственную пластинку также называются аденоматозным или диспластическим эпителием.
В азиатских странах оба вида поражения в желудке или толстой кишке называются «аденома», с разделением на полиповидные, плоские, и углубленные аденомы.
В классификации внутрислизистых неоплазий Венского консенсуса, термины «аденома» и «дисплазия» заменяет термин «интраэпителиальная неоплазия». Внешний вид зоны внутриэпителиальной неоплазии влияет на прогноз; высокий риск развития рака связан с углубленными поражениями.
Термин «рак De Novo» применяется к малым (часто менее 5 мм) плоским или углубленным раковым поражениям, когда нет аденоматозных желез в операционном материале. При этом предполагается, что рак развился не из аденоматозных или диспластических предшественников.
Гистологическая классификация неоплазий.
Согласительная классификация прогрессирующих опухолей в СО пищеварительного тракта была предложена после Венского симпозиума и пересмотрена недавно. Классификация применяется к многослойному плоскому эпителию и железистому эпителию (пищевод Барретта, желудок, толстая кишка). При отсутствии инвазии в собственную пластинку СО неинвазивные опухолевые поражения классифицируются по степени интраэпителиальной неоплазии (ИЭН) на две группы: низкой и высокой степени.
Пересмотренная Венская классификация эпителиальных неоплазий для пищевода, желудка и толстой кишки:
- Отрицательная ИЭН;
- Неопределенная ИЭН;
- ИЭН низкой степени
- Аденома/дисплазия
- ИЭН высокой степени (внутриэпителиальная или внутрислизистая)
- Аденома/дисплазия
- Неинвазивный рак
- Подозрение на инвазивный рак
- Внутрислизистая карцинома (инвазия в собственную пластинку)
- Подслизистый рак
Расхождений в оценке различий между дисплазией низкой степени и неопределенной дисплазией/интраэпителиальной неоплазией, а также между «отрицательной» и «неопределенной» дисплазией/интраэпителиальной неоплазией много, но их гораздо меньше в диагнозе дисплазия высокой степени. Интраэпителиальная неоплазия высокой степени с тяжелыми ядерными изменениями и сложной архитектоникой, соответствующей карциноме, также была названа «рак in situ».
Место разновидностей в терминологии.
В многослойном плоском эпителии пищевода термины «интраэпителиальная неоплазия высокой степени», «интраэпителиальная карцинома» и «рак in situ» эквивалентны. Когда есть инвазия в собственную пластинку СО, повреждение называют микроинвазивным или внутрислизистым раком.
В цилиндрическом эпителии пищевода Барретта, желудка, и толстой кишки, поражения с ИЭН высокой степени и без инвазии в собственную пластинку были названы внутрислизистым раком в Японии и дисплазией высокой степени в западных странах. Большинство этих расхождений исчезает, когда используется Венская согласительная классификация. В пересмотренном варианте классификации поражения, называемые «внутрислизистый рак» на Востоке и тяжелая дисплазия на Западе, стали подразделением одной группы.
Согласительная терминология делает различие между ИЭН высокой степени без инвазии в собственную пластинку и ИЭН высокой степени с инвазией в собственную пластинку. Последняя называется «внутрислизистая карцинома пищевода или желудка». В толстой кишке риск узловой инвазии в этой ситуации равен нулю, и на Западе имеет место тенденция избегать термина «карцинома» для поражений без инвазии в подслизистую оболочку, так как они полностью излечимы при помощи локальной эксцизии. Свыше этой стадии, все неопластические поражения с инвазией в подслизистый слой называются инвазивным раком.
Классификация TNM.
- До начала лечения с помощью диагностических тестов и процедур опухоль стадируется в соответствии с классификацией TNM; глубина инвазии опухоли в стенке кишечника соответствует Т классификации.
- В пищеводе, желудке, и толстой кишке эндоскопист классифицирует изменения «поверхностных» опухолевых поражений (интраэпителиальной неоплазии и рака) как варианты типа 0.
- Патологоанатом классифицирует гистологию опухоли по группам Венской классификации неоплазии.
- Когда доступен оперативный материал, глубина инвазии классифицируется морфологом в соответствии с T- по р-TNM классификации («р» - послеоперационный).
- В пищеводе и желудке интраэпителиальная опухоль без инвазии в собственную пластинку (р-Tis) называется «рак in situ» и не включается в реестры опухоли.
- Интраэпителиальная карцинома с инвазией в собственную пластинку СО называется р-T1m;
- Карцинома с инвазией в подслизистую оболочку – р-T1sm.
В толстой кишке терминов р-Tm и р-Tis, как правило, избегают на Западе, так как они не имеют клинической значимости в отношении выживания, и классифицируются как ИЭН высокой степени.
- Когда есть инвазия в подслизистую оболочку, опухоль определяется как р-T1sm.
Эта двойная гистологическая и TNM классификация представлена в последнем издании ВОЗ.
Таким образом, поверхностный рак в слизистой оболочке ЖКТ будет классифицироваться как
- р-Tis, р-Tm (пищевод, желудок) или
- р-Tsm (пищевод, желудок, толстая кишка).
МЕТОДОЛОГИЯ КЛАССИФИКАЦИИ
Эндоскопический поиск и хромоэндоскопия.
Последние модели видеоэндоскопов отвечают требованиям для получения высококачественного цифрового изображения с соответствующим разрешением, цветопередачей, а также увеличением структуры.
Первый шаг диагностики – выявление областей СО со слегка измененной окраской (более бледной или более красной), нерегулярной микрососудистой сетью или небольших возвышенных или углубленных участков.
Второй шаг диагностики основан на хромоскопии, позволяющей детально описать поражение. Хромоскопия должна быть доступна и выполняться при обнаружении поражения. Рутинное использование эндоскопических красителей для улучшения визуализации очаговых поражений не означает, что окрашивание всей поверхности СО должно быть выполнено в каждом случае. Диффузное (тотальное) окрашивание рекомендовано в случаях высокого риска развития новообразований (например, при семейном колоректальном раке или неспецифическом язвенном колите).
Основным красителем, используемым для многослойного плоского эпителия пищевода, является водный раствор Люголя (1-2%). Опухолевые области остаются неокрашенными (отрицательная окраска), в отличие от темно-коричневой (положительной окраски) нормального эпителия.
Наиболее часто применяемый краситель на измененных участках СО желудка и толстой кишки – индигокармин (0,5% -1% раствор), контрастирует рельеф СО, выделяя повреждения ее целостности, неровности рельефа, нарушения архитектоники.
Хромоскопия с индигокармином помогает различить неопухолевые (гиперпластические) и опухолевые поражения в толстой кишке.
Хромоскопия метиленовым синим обнаруживает очаги КМ в пищеводе и желудке и используется в толстой кишке путем распыления 0,1% раствора посегментно.
В недавнем рандомизированном исследовании эта процедура была применена для наблюдения у пациентов с язвенным колитом. Повысить выявляемость неполипозных опухолевых поражений удалось в группе пациентов, обследованных с применением хромоскопии и увеличительной эндоскопии. Оптическое увеличение было расценено как основной фактор повышения эффективности.
Эндоскопическое применение разбавленной уксусной кислоты предложено в качестве красителя при изучении метапластической слизистой пищевода Барретта.
Видео- и фоторегистрация образований, обнаруженных при эндоскопии, стала доступной с переходом на цифровое оборудование, использующейся в современной эндоскопии. Такие записи оказались полезными при последующих наблюдениях. Выбор наиболее показательных изображений для каждого поражения – обычная практика в Японии. Рутинные записи изображений для всех процедур недавно были включены в руководящие принципы Европейского общества гастроинтестинальной эндоскопии и практикуются во многих учреждениях во всем мире.
Эндоскопическая классификация типа 0.
Во время эндоскопии оценка поверхностных опухолевых поражений СО ЖКТ основывается на количественных и качественных критериях.
Во-первых, размер поражения и его диаметр измеряются настолько точно, насколько это возможно, предпочтительно с использованием градуированного измерительного инструмента.
После чего поражение классифицируется по одному из 5 типов модифицированной японской классификации Borrmann для распространенного рака или типу 0, если внешний вид поражения соответствует поверхностному поражению (слизистая оболочка или подслизистый слой). На данном этапе макроскопическая классификация определяется «внешним видом». Классификация не должна зависеть от какой-либо предшествующей информации и не должна меняться по данным патологоанатома. Это означало бы, что полученная картина при эндоскопии может быть признана недействительной по результатам гистологического заключения.
Поражение, выглядящее как тип 0 при эндоскопическом исследовании, может оказаться распространенным раком при морфологической классификации по р-TNM или наоборот.
В японских исследованиях большинство поверхностных эндоскопических поражений классифицируются в соответствии с подтипами типа 0; это относится к плоскоклеточным ракам пищевода, аденокарциномам кардиального и дистального отделов желудка, толстой кишки и прямой кишки. Японская классификация иногда используется западными исследователями для опухолевых поражений в пищеводе Барретта, а также толстой кишки (в сотрудничестве с японскими экспертами).
Тип 0 поражений делится на 3 основные группы:
• тип 0-I, полиповидный
• тип 0-II, неполиповидный и неуглубленный
• тип 0-III, неполиповидный с явной язвой
Тип 0-I подразделяется на 2 варианта:
• на ножке (0-Iр)
• сидячий (0-IS)
Тип 0-II подразделяется на 3 варианта:
• слегка приподнятое (0-IIа)
• абсолютно плоское (0-IIв)
• слегка углубленное (0-IIс)
Различие между углубленным (0-IIc) и подрытым (язвенным) поражениями (0-III) легко определить в оперативном образце.
Подрытые поражения характеризуются значительным нарушением эпителиального слоя и мышечной пластинки СО.
Смешанные варианты связывают два различных типа опухоли. Приподнятые (IIa) и углубленные (IIc) варианты опухоли довольно легко диагностируется при эндоскопическом исследовании. Тем не менее, определение типа опухоли согласно японской классификации требует максимально точной оценки макроскопической картины, что является областью разногласий, так как поверхность каждого типа не единственный значимый фактор для прогноза.
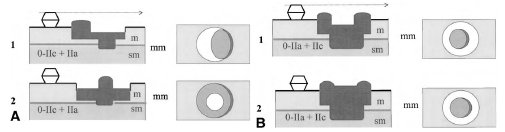
Углубленные поражения с приподнятыми границами или возвышением в центре классифицируются как тип 0-IIc + IIa (рис. 4).
Приподнятые поражения с центральным углублением на их верхушке классифицируются как тип 0-IIa + IIc. Этот вариант включает в себя относительно углубленные поражения, в которых депрессивные участки не ниже уровня нормальной слизистой. Как правило, поражения типа IIa + IIc имеют менее благоприятный прогноз, с большим риском инвазии в подслизистый слой, чем все остальные типы повреждений, имеющие структуру IIa.
Рекомендации по применению классификации
• В прагматичном и простом подходе, обязательном для классификации поверхностных поражений, присутствует, по крайней мере, один из 5 основных типов: 0-I, 0-IIa, 0-IIb, 0-IIc, 0-III. Относительные пропорции каждого типа отличаются в пищеводе, желудке и толстой кишке.
• Полиповидные поражения 0-I можно разделить на тип 0-Ip и тип 0-Is (на ножке и сидячие). Отсутствие клинического значения делает ненужным введение промежуточного типа 0-Isр (наполовину на ножке); такие повреждения классифицируются как тип Is.
• Особое внимание уделяется повреждениям углубленного типа 0-IIc. Различия между углубленными поражениями (0-IIc) и язвенными поражениями (0-III) при эндоскопии основаны на глубине депрессии и анализе эпителиальной поверхности в углубленном участке. Поверхностные эрозии в углубленном поражении затрагивают только самые поверхностные слои. В изъязвленном поражении есть потеря СО и часто подслизистой основы. В толстой кишки тип 0-IIc даже небольшого диаметра – часто с более тяжелой стадией неоплазии, с большей инвазией, чем другие типы.
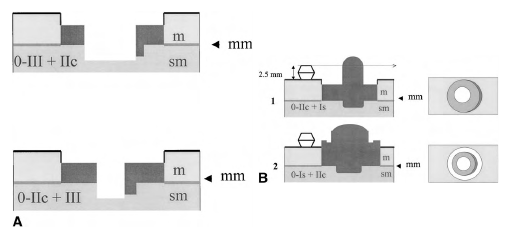
• Маленькие приподнятые опухолевые поражения, соответствующие в классификации полиповидным сидячим (тип 0-Is) или неполиповидным приподнятым (тип 0-IIa), различить проще, поставив щипцы для биопсии рядом с поражением, как калибровочный датчик. Этот стандарт применяется к высоте поражения, а не его диаметру. Поражения, выступающие над уровнем закрытых бранш щипцов для биопсии (около 2,5 мм), классифицируются как 0-Is; поражения ниже этого уровня классифицируются как 0-IIa (см. рис. 2).
• При наличии депрессии в центре опухолевого поражения его уровень сравнивается с окружающей СО. Поражение классифицируется как абсолютно углубленное, если уровень депрессии ниже, чем поверхность окружающей СО, и как относительно углубленное, когда депрессия по-прежнему выше, чем поверхность окружающей СО; это особенно важно для толстого кишечника.
• Те же качественные и количественные критерии используются для классификации новообразований в цилиндрическом эпителии пищевода Барретта, желудка, и толстой кишки. Они применяются также для неоплазий в двенадцатиперстной кишке или тонком кишечнике.
• В пищеводе неоплазии в многослойном плоском эпителии классифицируется на идентичные основные подтипы, но с другими количественными критериями. Стандартом для сравнения является одна чашка открытых биопсийных щипцов. Поражения, выступающие выше уровня чашки (приблизительно 1,2 мм), классифицируются как 0-Is. Глубину углубленных поражений сравнивают с половиной уровня одной чашки (около 0,6 мм).
Поражения, включенные в классификацию.
Классификация типа 0 неопластических образований распространяется на рак, доброкачественные интраэпителиальные неоплазии, как легкой, так и высокой степени, а также неопухолевые поражения, которые могут нести в себе опухолевый компонент (например, гиперпластические полипы).
Ряд морфологических изменений поверхности СО, связанных с воспалением, являются только факторами риска и не включены в классификацию типа 0.
Это относится и к воспалительным поражениям при эзофагитах, связанных с плоскоклеточным раком в части Азии, и к хроническим гастритам, ассоциированным с НР, связанным с раком желудка. Это правило также применяется к специализированной кишечной метаплазии в пищеводе Барретта (фактору риска развития рака) и кишечной метаплазии (ассоциированной с воспалением и атрофией) в желудке.
Хотя существуют четкие эндоскопические признаки кишечной метаплазии при использовании хромоскопии или увеличительной эндоскопии, эти морфологические разновидности не отражаются в классификации типа 0.
В желудке большинство поражений с неоплазией легкой степени никогда не прогрессирует в рак, в то время как неинвазивная интраэпителиальная неоплазия высокой степени легко развивается в рак. Исследования с биомаркерами подтверждают, что опухолевые поражения в кардии имеют различный патогенез по сравнению с образованиями в дистальной части желудка. Специфические ИГХ-характеристики являются атрибутом кишечной метаплазии пищеводно-желудочного перехода и желудка. Аденомы желудка редки и в большинстве своем не прогрессируют в рак. Изолированные неопухолевые гиперпластические полипы редко подвергаются опухолевой трансформации, но это происходит при полипозе желудка.
Зубчатые аденомы в желудке редки.
В толстой кишке неопухолевые полипы встречаются часто. По этой причине в национальном исследовании полипов в США из собранного материала 8,5% пациентов были исключены. Большинство неопухолевых гиперпластических полипов невыступающие и их слегка возвышенный внешний вид может быть классифицирован как тип 0-IIa. Аберрантные крипты считаются самыми ранними предшественниками колоректального новообразования, но прогрессия в макроскопические опухолевые поражения вероятно редка. На самом деле, аберрантные крипты, которые могут быть обнаружены при увеличительной эндоскопии как небольшие протрузии, можно расценить как мельчайшие примеры поражений типа 0.
Относительно толстой кишки многие японские эксперты подчеркивают роль неполиповидных предшественников и высокий темп прогрессирования углубленных образований. Однако это также может быть интерпретировано и как различие в терминологии, поскольку маленькие аденомы с высокой степенью неоплазии на Западе могут быть названы раком «De Novo»' в Японии.
В западной интерпретации небольшие аденомы с дисплазией высокой степени могут быстро развиться в небольшой плоский инвазивный рак, что зачеркивает доказательства его аденоматозного происхождения. Это, вероятно, один из основных путей наследственных неполиповидных раков толстой кишки (HNPCC).
Существуют западные тенденции принятия более широкого спектра прогрессии для опухолевых поражений, в том числе роль неполиповидных поражений и концепцию рака «De Novo». Молекулярная биология предполагает, что неполиповидные поражения имеют четкую эволюцию с большой вероятностью ранней мутации p53 и поздней K-Ras. Зубчатые аденомы, классифицируемые как опухолевые поражения, могут демонстрировать биомаркеры, аналогичные неполипозным опухолевым поражениям.
Эндоскопическое стадирование.
Макроскопический вид опухолевых поражений типа 0 имеет прогностическое значение для оценки глубины инвазии в стенку пищеварительного тракта, определяет «эндоскопическую тактику». Таким образом, эндоскопическое описание может помочь в определении тактики лечения, связанной с эндоскопической резекцией или хирургическим вмешательством. Основная роль эндоскопического стадирования – выявить риск инвазии в подслизистый слой и связанный с этим риск метастазов в лимфоузлы.
Для поражений типа 0-I диаметр является надежным предиктивным критерием. Риск подслизистой инвазии возрастает с увеличением диаметра. При поражениях типа 0-II большее значение имеют морфологические подтипы. Инвазия в подслизистый слой выявляется чаще в углубленных поражениях (IIс).
Для увеличения надежности эндоскопического стадирования может использоваться EUS, в частности высокочастотные датчики (20 МГц). Оба метода, эндоскопическое морфологическое стадирование и EUS, имеют свои пределы. Эндоскопия стремится к изучению поверхности поражения, EUS – к его стадированию. Когда оба методы согласованы, прогностическая ценность высока.
Рисунок 1. Варианты типа 0 опухолевых поражений ЖКТ: полиповидные (Ip и Is), неполиповидные (IIa, IIb и IIc) и подрытые (III)
Рисунок 2. Тип 0-I: на ножке (Ip) или сидячие (Is) в поперечном сечении.
Рисунок 3. Тип 0-II приподнятый (IIa), абсолютно плоский (IIb), углубленный (IIc).
Рисунок 4. Комбинированные типы 0-IIa и 0-IIc. В поперечном сечении поражения в сравнении с закрытыми браншами биопсийных щипцов (2,5 мм). При прямом обзоре: приподнятые и углубленные зоны представлены в различных затемнениях.
А. Типы IIc + IIa: приподнятая зона в углубленном поражении.
B. Типы IIa + IIc: углубленный участок в приподнятом образовании. В варианте 2, углубленная зона не достигает уровня окружающей слизистой оболочки, что является относительно углубленным поражением.
Рисунок 5. Тип 0-III подрытый. В желудке дно поражение неопухолевое. В пищеводе Барретта опухолевая область охватывает всю поверхность поражения
Рисунок 6. Комбинированные поражения в поперечном разрезе по сравнению с высотой закрытой чашки щипцов для биопсии (2,5 мм). Во фронтальном разрезе, возвышенные, углубленные или относительно углубленные зоны слизистой оболочки представлены различными оттенками
А. Комбинированные типы 0-III и 0-IIc. Тип III + IIc: в основном подрытое образование с углубленной зоной. Тип IIc + III: небольшая подрытая зона в углубленном образовании
B. Комбинированные типы 0-Is и 0 - IIc. Тип IIc + Is заключается в следующем: пунктирная стрелка проходит ниже возвышенной зоны. Тип Is + IIc: углубленная зона выше, чем окружающая слизистая оболочка; это относительно углубленное поражение
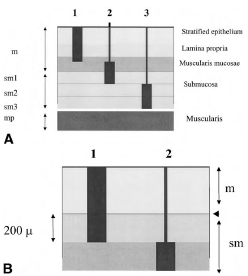
Рисунок 7. Глубина инвазии в подслизистый слой в цилиндрическом эпителии (пищевод Барретта, желудок, толстая кишка и прямая кишка) оценивается в образце, полученном после операции. Глубина инвазии в подслизистый слой разделена на две группы: поверхностная (SM1) и глубокая (SM2) по строго установленным показателям микрометрической шкалы (500 µ в желудке, 1000 µ в толстой кишке)
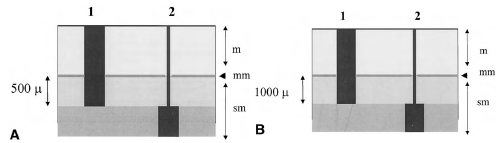
Рисунок 8. Глубина инвазии в подслизистый слой в цилиндрическом эпителии оценивается по клиническому значению для EMR и риска возникновения метастазов в лимфоузлы. Группа 1 (m и sm1): EMR возможно. Группа 2 (sm 2): хирургическое лечение является предпочтительным. A. Пищевод Барретта и желудок: граница между sm1 и sm2 составляет 500 µ. B. В толстой и прямой кишке: граница между sm1 и sm 2 составляет 1000 µ
Рисунок 9. Плоскоклеточные новообразования в пищеводе. Адаптированный масштаб толщины в поперечном сечении для основных подтипов: полиповидный, неполиповидный и углубленный, m и sm представлены в виде одного слоя. Выступающие поражения сравнивается с одной открытой чашкой биопсийных щипцов (1,2 мм); пунктирная стрелка проходит над верхней границей Is и IIa поражений. Углубленные поражения сравниваются с половиной высоты открытой чашки биопсийных щипцов
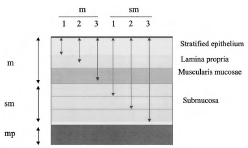
Рисунок 10. Глубина инвазии в плоскоклеточном эпителии пищевода.
Слизистая карцинома разделены на три группы:
m1 – внутриэпителиальная,
m2 – микроинвазивная (инвазия до базальной мембраны) и
m3 – интрамукозальная (инвазия в мышечную пластинку слизистой оболочки).
Глубина инвазии в подслизистый слой делится на три уровня эквивалентной толщины:
поверхностная (sm1),
средняя (sm2) и
глубокая (sm3)
Рисунок 11. Глубина инвазии при неоплазии плоскоклеточного эпителия в пищеводе адаптированная к EMR и оценки риска метастазов в лимфоузлы.
А. Полная толщина образца.
Группа 1 (m и sm1): EMR возможна.
Группа 3 (sm 2 и 3): хирургическое лечение.
Группа 2 (m3 и sm1): неопределенные показания.
В. В образце, извлечённом после EMR при отсечении на уровне между sm1 и sm2 и толщиной 200 нанометров, EMR адекватна для поражения на уровне sm1.
Полностью с текстом можно ознакомиться: The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon. November 30 to December 1, 2002 // Gastrointest. Endosc. – 2003. – Vol. 58. – Р.83-89, 810-843.


















.jpg)




.png)

















Комментарии 3