- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Классификации
- Атлас
- Quiz
- Разделы
- Пациенту
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Показатели качества в диагностической эндоскопии верхних отделов желудочно-кишечного тракта
| Авторы: | Wladyslaw Januszewicz and Michal F. Kaminski |
Аннотация:
Эндоскопия верхних отделов желудочно-кишечного тракта (UGI) является важной клинической услугой, спрос на которую постоянно растет во всем мире. Его полезность соответствует различным эпидемиологическим проблемам во всем мире, при этом скрининг рака и эпиднадзор являются высшим приоритетом. Несмотря на высокую точность обнаружения новообразований, эндоскопия UGI остается в значительной степени зависимой от оператора процедурой, характеризующейся значительным количеством пропущенных патологий.

Введение
Эндоскопия желудочно-кишечного тракта является важной клинической услугой, спрос на которую постоянно растет. 1 Эзофагогастродуоденоскопия (EGD), в частности, стала ключевой диагностической процедурой в верхних отделах желудочно-кишечного тракта (UGI), в основном для выявления и наблюдения предраковых состояний и рака. Данные из Соединенных Штатов (США) показали, что в течение первого десятилетия нового тысячелетия использование эндоскопии увеличилось более чем на 50% 1, и эта тенденция сохраняется и по сей день. Например, только в 2009 году в США было проведено 6,9 миллиона ЭГД, что составило 12,3 миллиарда долларов (только в амбулаторных условиях). 1Более свежие данные из Соединенного Королевства (Великобритания) показали, что в 2016 году в Великобритании было проведено более 1,2 миллиона EGD (как терапевтических, так и диагностических) 2.
Полезность EGD соответствует различным эпидемиологическим проблемам во всем мире. В регионах с высоким риском рака желудка, таких как Япония и Южная Корея, ФГД не только стала признанной альтернативой рентгеновской фотофлюорографии в качестве метода скрининга первой линии, но и постепенно заменяет ее. 3 В западном мире, с другой стороны, резко увеличивающаяся заболеваемость аденокарциномой пищевода (EAC) стала важной эпидемиологической проблемой. 4 Поскольку у этого злокачественного новообразования есть предшественник эндоскопически обнаруживаемого (и потенциально излечимого) поражения - пищевода Барретта (ПБ), рекомендуется проведение эндоскопического скрининга для лиц из группы высокого риска. 5- 7
Очевидно, что полезность EGD растет во всем мире, и с ростом спроса необходимо обеспечить высочайший стандарт качества. Важность оценки качества в эндоскопии уже была исследована в области колоноскопии. С момента его появления в качестве скринингового теста на колоректальный рак, значительный объем исследований был посвящен разработке показателей качества. Это измеримые параметры индивидуальной работы, обычно связанные с процедурной диагностической эффективностью (например, положительная корреляция времени отмены колоноскопии с частотой обнаруженных аденом) и ориентированными на пациента результатами (например, обратная связь между частотой выявления аденомы и заболеваемостью раком после колоноскопии. ). 8- 10
Несмотря на растущий интерес к теме показателей качества для EGD, отраженный в недавно опубликованных руководящих принципах и позициях 11- 14 качественных показателей для этой процедуры пока не хватает. Большинство представленных показателей основаны на недостаточных доказательствах и редко связаны с результатами, ориентированными на пациента. 11- 14 Учитывая значительное количество случаев рака UGI, пропущенных во время эндоскопии, а именно 11,3%, согласно недавнему метаанализу 15, вопрос контроля качества EGD имеет первостепенное значение.
Этот обзор направлен на представление установленных и новых показателей качества для эндоскопии UGI. В нем собраны текущие рекомендации, взятые в основном из западных эндоскопических обществ, со ссылками на азиатские рекомендации, где это необходимо. Статья посвящена диагностической ФГДС и не охватывает показатели качества терапевтических процедур. Сводка основных показателей качества, обсуждаемых в статье, представлена в таблице 1 .
Показатели качества перед процедурой
|
Table 1. Summary of key quality metrics in UGI endoscopy. | ||||
|
Quality measure |
ESGE (2016)12 |
AGAI2015)13 |
BSG (2017)11 |
Asian consensus14 |
|
Pre-procedure quality indicators |
|
|
| |
|
List of actions before commencing the procedure: |
• Proper fasting instructions: 2h for liquids and 6h for solids (target: =s95%) |
• EGD indication appropriateness (target: >80%] • Informed consent [target: >98%) • Patient'history review and physical examination (target: >98%) • Risk of AE assessment and documentation (target: >98%) • Administration of prophylactic antibiotics when necessary [target >98%) • Sedation plan documentation (target: >98%) • Management and documentation of antithrombotic therapy • Team pause (target: >98%) • Competent endoscopist (target: >98%) |
• Assessment of fitness • Providing information about the procedure including informed consent and safety checklist (before and after the procedure) • Appropriate time slot allocation for the procedure • Competent endoscopist |
• Risk stratification regarding UGI cancers and high-risk findings in previous EGD |
|
Use of mucolytics/ defoaming agents |
• Not specified |
• Not specified |
• Recommended |
• Recommended (+ the use of antispasmodic agents when necessary) |
|
Use of sedation |
• Not specified |
• Recommended |
• When required |
• Recommended |
|
Intra-procedure quality indicators |
|
|
| |
|
Competence |
• Not specified |
• Not specified |
• Minimum procedure rate: >100 EGDs/year |
• Structured training (e-learning, voluntary training programmes) |
|
Procedural time |
• Minimum 7min. (Target: э=90%) |
• Not specified |
• Minimum 7min. Procedure time documented in BE and gastric premalignant conditions surveillance |
• Minimum 8 min. (including taking of a standard minimum number of photos) |
|
Photodocumentation |
• Minimum 10 images. Photodocumentation should include representative image of: duodenum, major papilla, antrum, angulus, corpus, retroflex of the fundus, diaphragmatic indentation, upper end of the gastric folds, squamocolumnar junction, distal and proximal esophagus + any detected lesion |
• Not specified |
• 8 anatomical landmarks [upper esophagus, GEJ, fundus in retroflexion, stomach body, incisura, antrum, duodenal bulb, distal duodenum) + any detected lesion |
• Systematic screening protocol for the stomach (SSS) 22 endoscopic photos from three to four quadrants at specific locations in the stomach |
|
Biopsy protocols |
• Barrett's esophagus Seattle biopsy protocol (Target: >90%) •Gastric premalignant conditions MAPS biopsy protocol (target: >90%) |
• Barrett's esophagus Seattle protocol • Gastric ulcers >4 biopsies in non-bleeding ulcers to exclude malignancy (target: >80%) |
• Barrett's esophagus Seattle protocol • Eosinophilic esophagitis Biopsies from two different regions in the esophagus • Celiac disease: Minimum 4 biopsies from D2 including a specimen from the duodenal bulb |
• Not specified |
|
Image enhancing techniques |
• Lugol's chromoendoscopy for suspected squamous neoplasia (target: >90%) |
• Not specified |
• Lugol's chromoendoscopy for suspected squamous neoplasia |
• Overall recommended to: - improved the detection rate of esophageal superficial neoplasia and gastric premalignant changes - delineate UGI superficial neoplasia - characterize of UGI superficial neoplasia [magnifying endoscopy + NBI) |
|
Post-procedure quality indicators |
|
|
| |
|
Registration of complications |
• Recommended after therapeutic procedures (target: >95%) |
• Recommended: - immediate adverse events requiring interventions - delayed adverse events leading to hospitalization or additional procedures or medical interventions occur within 14days |
• Recommended - readmission, mortality and complication rates |
• Not specified |
|
Patients satisfaction data |
• Not specified |
• Recommended |
• Recommended |
• Not specified |
|
AE, adverse event; AGA, American Gastroenterological Association; BE, Barrett's esophagus; BSG, British Society of Gastroenterology; EGD, esophagogastroduodenoscopy; ESGE, European Society of Gastrointestinal Endoscopy; GEJ, gastroesophageal junction; MAPS, management of precancerous conditions and lesions in the stomach; NBI, narrow-band imaging; UGI, upper gastrointestinal tract. | ||||
Подготовка
Все пациенты, которым проводится эндоскопия, должны быть точно проинформированы о самой процедуре, показаниях к ней, рисках, которые она повлечет за собой, и способах лечения потенциальных осложнений. Подготовка пациента включает в себя правильные инструкции по голоданию - ключевой показатель эффективности согласно Европейскому обществу гастроинтестинальной эндоскопии (ESGE). 12 На основании имеющихся данных ESGE определяет адекватное время голодания как минимум 2 часа для жидкости и 6 часов для твердой пищи. 12 Несмотря на то, что это не включено в рекомендации, пациенты с известной задержкой опорожнения желудка (гастропарез) могут получить пользу от более продолжительного голодания (например, ночного голодания) в каждом конкретном случае. 16Перед ФГДС пациенты должны получить легко понятный информационный лист о процедуре, и, если это не экстренная процедура, всегда следует получать информированное подписанное согласие.
Подготовка к процедуре также включает оценку состояния здоровья пациента. Наиболее частые клинические проблемы, требующие внимания перед эндоскопией, включают лечение диабета, антикоагулянтную терапию, необходимость в профилактических антибиотиках и потребности в седативных средствах. Шкала Американского общества анестезиологов (ASA) - это наиболее часто используемая система оценки для классификации пациентов по их физиологическому статусу и прогнозирования операционного риска. По шкале 17 баллов ASA пациенты классифицируются по шести категориям (ASA 1–6), от нормального здорового пациента, пациента с легким и тяжелым системным заболеванием до умирающего пациента с мертвым мозгом, как представлено в таблице 2 .
Таблица 2. Оценка по шкале ASA. 15 Последний раз одобрен Палатой делегатов ASA 15 октября 2014 г. ASA score.
|
ASA Classification |
Definition |
Examples, including, but not limited to: |
|
ASA I |
A normal healthy patient |
Healthy, non-smoking, no or minimal alcohol use |
|
ASA II |
A patient with mild systemic disease |
Mild diseases only without substantive functional limitations. Examples include (but not limited to): current smoker, social alcohol drinker, pregnancy, obesity (BMI > 30) |
|
ASA III |
A patient with severe systemic disease |
Substantive functional limitations; one or more moderate to severe diseases. Examples include (but not limited to): poorly controlled DM or HTN, COPD, morbid obesity (BMI 40), active hepatitis, alcohol dependence or abuse, implanted pacemaker, moderate reduction of ejection fraction, ESRD undergoing regularly scheduled dialysis, premature infant PCA < 60weeks, history (>3months) of Ml, CVA, TIA, or CAD/stents. |
|
ASA IV |
A patient with severe systemic disease that is a constant threat to life |
Examples include (but not limited to): recent (<3months) Ml, CVA, TIA, or CAD/stents, ongoing cardiac ischemia or severe valve dysfunction, severe reduction of ejection fraction, sepsis, DIC, ARD or ESRD not undergoing regularly scheduled dialysis |
|
ASAV |
A moribund patient who is not expected to survive without the operation |
Examples include (but not limited to): ruptured abdominal/thoracic aneurysm, massive trauma, intracranial bleed with mass effect, ischemic bowel in the face of significant cardiac pathology or multiple organ/system dysfunction |
|
ASA VI |
A declared brain-dead patient whose organs are being removed for donor purposes |
|
ASA, American Society of Anesthesiologists; BMI, body mass index; CHF, congestive heart failure; CAD, coronary artery disease; COPD, chronic obstructive pulmonary disease; CVA, cerebrovascular accident; DIC, disseminated intravascular coagulation; DM, diabetes mellitus; ESRD, endstage renal disease; HTN, hypertension; Ml, myocardial infarction; TIA, transient ischemic attack.
Появляется все больше свидетельств того, что контрольные списки хирургической безопасности могут предотвратить ошибки и, таким образом, положительно повлиять на заболеваемость и смертность пациентов. 18 Несмотря на отсутствие стандартизированного контрольного списка для использования эндоскопии, Британское общество гастроэнтерологии (BSG) определило базальные области, которые должны быть включены в такой документ: идентификаторы пациентов (имя / номер больницы / дата рождения); аллергия; лекарства и состояния, которые могут исключить любые вмешательства, такие как использование антикоагулянтов или серьезные сопутствующие заболевания; понимание пациентом предлагаемого теста; заполнение формы согласия. 11
Хотя в повседневной практике это не используется, премедикация пеногасителями (например, симетиконом) и муколитиками (например, проназой или N-ацетилцистеином) для улучшения визуализации слизистой оболочки во время EGD все чаще обсуждается. В недавнем многоцентровом рандомизированном контролируемом исследовании (РКИ) 7200 скрининговых EGD премедикация проназой и симетиконом значительно увеличивала видимость слизистой оболочки UGI тракта, хотя это не повлияло на скорость выявления неоплазии. 19 Другое РКИ показало, что комбинация N-ацетилцистеина и симетикона, принимаемая за 20 минут до EGD, значительно улучшала видимость слизистой оболочки по сравнению с отсутствием вмешательства и водным препаратом. 20Азиатский консенсус по диагностическим стандартам для эндоскопии UGI рекомендует использовать муколитические и пеногасители для улучшения визуальной четкости во время EGD. 14 В отличие от колоноскопии, нет утвержденной шкалы для оценки подготовки слизистой оболочки тракта UGI. Тем не менее, для целей предыдущих исследований была создана специальная система оценки видимости слизистой оболочки. 21 Эта система может использоваться в повседневной практике и основана на 4-уровневой шкале видимости слизистой оболочки в диапазоне от 1 до 4 (1 - отсутствие прилипшей слизи; 2 - слабая слизь, но не затемняет зрение; 3 - большое количество слизи. затемнение зрения и 4- обильная прилипшая слизь). 21 годESGE рекомендует включать в отчеты EGD информацию о содержимом желудка, таком как остатки пищи, кровь, желчь или наличие пузырьков, а также информацию о том, использовалась ли водяная струя для улучшения визуализации слизистой оболочки. 12
Целесообразность показаний
Просмотр формы направления на эндоскопию вместе с показаниями к процедуре остается важной задачей перед выполнением любого эндоскопического исследования. Эндоскописты должны быть знакомы со стандартным списком показаний для EGD и индивидуально рассматривать каждый вариант из него. Представление полного списка показаний выходит за рамки данной статьи, но его можно найти в предыдущих документах, таких как рекомендации по качеству Американского колледжа гастроэнтерологии (ACG) и Американского общества гастроинтестинальной эндоскопии (ASGE). 13 , 22 ACG / ASGE подразумевают, что показания для EGD должны быть задокументированы и соответствовать опубликованному стандартному списку как минимум в 80% случаев. 23
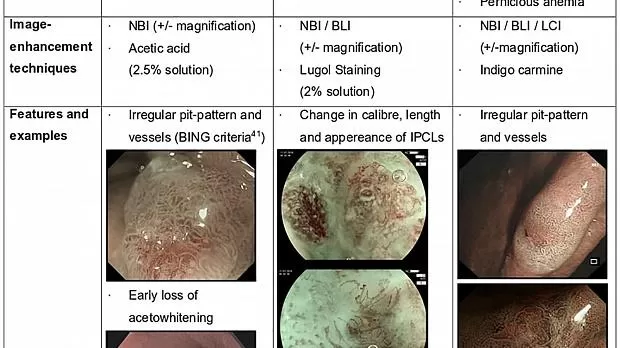
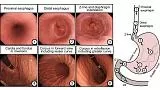
Кроме того, просмотр показаний и доступных клинических данных дает возможность идентифицировать пациентов с повышенным риском рака UGI. Для таких пациентов следует рассмотреть более низкий порог подозрительных поражений при биопсии и заранее подготовить соответствующие методы улучшения изображения . Азиатский консенсус подчеркивает необходимость стратификации риска пациентов перед каждой диагностической ФГДС. 14Например, пациенты мужского пола, у которых в анамнезе был рак головы и шеи, а также чрезмерное употребление алкоголя или курение табака в анамнезе, подвержены повышенному риску плоскоклеточного рака пищевода (ESCC). Эти пациенты должны пройти подробный осмотр по всей длине пищевода, желательно с использованием передовых методов визуализации (описанных ниже). С другой стороны, мужчины кавказского происхождения с ожирением и длительным анамнезом гастроэзофагеальной рефлюксной болезни (ГЭРБ) подвергаются повышенному риску развития ЭАА, связанного с БЭ, и требуют тщательного обследования желудочно-пищеводного соединения (ГЭП) и сегмента ВЭ, если подарок. Рисунок 1 представлены общие клинические профили высокого риска и соответствующее эндоскопическое лечение.
Рис. 1. Клинические профили высокого риска и эндоскопические особенности.
BING, международная группа NBI Барретта; BLI, синяя лазерная визуализация; EAC, аденокарцинома пищевода; ESCC, плоскоклеточный рак пищевода; ГЭРБ, гастроэзофагеальная рефлюксная болезнь; IPCL, внутрипапиллярные капиллярные петли; LCI, связанная цветная визуализация; NBI, узкополосная визуализация.
Наконец, выявление лиц из группы высокого риска дает возможность подготовить более длительные интервалы для обследования при проведении эндоскопических списков. В рекомендациях BSG рекомендуется выделять для стандартной диагностической эндоскопии минимум 20 минут, увеличиваясь по мере необходимости для наблюдения за состояниями высокого риска. 11
Показатели качества внутри процедуры
Компетентность
По-прежнему сложно оценить компетентность и дать стажерам разрешение на выполнение ЭГД без надзора. Спорный момент, когда эндоскописты UGI становятся технически компетентными, потому что в большинстве учреждений обучение эндоскопии носит индивидуальный и довольно неформальный характер. Предыдущие исследования кривой обучения EGD показали, что для достижения технической компетентности необходимо не менее 100 контролируемых процедур. 24 Более недавнее исследование, в котором проанализировано 243 555 EGD, зарегистрированных в базе данных Объединенной консультативной группы по эндоскопии желудочно-кишечного тракта (JAG), показало, что для поддержания 95% процентного завершения процедуры требуется не менее 200 процедур для большинства стажеров (90%). 25В этом исследовании частота полных процедур была положительно связана с предыдущим опытом эндоскопии нижних отделов ЖКТ и старшим возрастом стажера. 25 Согласно этим данным, как в Великобритании, так и в Австралии требуется минимум 200 полных процедур без посторонней помощи для достижения компетентности в диагностической EGD. 26 , 27 Аналогичным образом, в Канаде требуется как минимум 150 процедур (включая ≥100 без посторонней помощи), а в США требуется 130 процедур. 28 , 29 Интересно, что в Южной Корее, по данным Корейского общества эндоскопии желудочно-кишечного тракта (KSGE), для достижения компетентности рекомендуется не менее 1000 EGD. 30
Появляется все больше доказательств того, что структурированные тренировки могут улучшить обнаружение поверхностных новообразований. В последние годы стало доступно несколько обучающих видео-программ в Интернете для выявления ранних заболеваний. Например, эффективность модуля электронного обучения для раннего распознавания рака желудка оценивалась в международном многоцентровом РКИ с участием 332 эндоскопистов из 35 стран. 31 После предварительного тестирования 40 наборов эндоскопических изображений участники были случайным образом распределены в группы с электронным обучением или без электронного обучения, и через 2 месяца обе группы прошли пост-тест. Исследование показало средний уровень улучшения в распознавании ранних стадий рака желудка на уровне 1,4 (± 0,26) и 1,0 (± 0,16) для групп электронного и не-электронного обучения, соответственно ( p <0,001). Азиатские рекомендации подчеркивают преимущества структурированного обучения в повышении частоты выявления поверхностной неоплазии UGI. 14
Скорость полных процедур
В настоящее время частота полных обследований, определяемая как доля выполненных без посторонней помощи EGD с успешной интубацией второй части двенадцатиперстной кишки (D2), остается основным критерием при оценке компетентности в диагностической эндоскопии UGI. В Великобритании, например, JAG требует, чтобы стажеры интубировали D2 и выполняли J-маневр (ретрофлексию желудка) в ≥95% процедур. 26 В США показатель завершения EGD является ключевым показателем качества в соответствии с Инициативой исследования клинических результатов (CORI) - центральной электронной базой данных, отслеживающей результаты эндоскопии. Рекомендуется целевая процентная ставка завершения процедуры ≥98%. 13
Время процедуры
Время процедуры до сих пор является наиболее изученным параметром качества диагностической EGD. ESGE рекомендует, чтобы все отчеты эндоскопии регулярно включали время процедуры (цель: ≥90% отчетов) 12, и BSG требует этого, по крайней мере, для процедур наблюдения в условиях высокого риска, таких как ПБ и предраковый желудок [атрофический гастрит (АГ) и желудочно-кишечная метаплазия (ЖИМ)]. 11 Однако определение времени процедуры EGD варьируется в зависимости от исследования. Некоторые определяют его как время от интубации до экстубации пациента 32, в то время как другие учитывают только время отрыва от D2 до экстубации («время осмотра»). 33 Также остается неясным, включать ли время, потраченное на взятие биопсии, во время процедуры.
В исследовании Gupta et al . Было показано, что эндоскописты, которые тратили не менее 1 минуты на каждый 1 см окружного сегмента BE, выявляли более подозрительные поражения (54,2% против 13,3%, p = 0,04) и, как правило, выявляли больше очагов. распространенной неоплазии [дисплазия высокой степени (HGD) / EAC] по сравнению с эндоскопистами, которые тратят на осмотр <1 мин (40,2% против 6,7%, p = 0,06). 34 После этого исследования ESGE включила рекомендацию о минимальном времени осмотра в 1 мин на каждый 1 см BE в качестве незначительной меры производительности. 12
В последующем исследовании, проведенном в Сингапуре, была проанализирована связь времени, затраченного на рутинное обследование на ФГД, и обнаружение предраковых поражений и рака желудка. 32 Средняя продолжительность «нормального» исследования EGD, определяемого как исследование, которое не выявляет каких-либо отклонений и не требует биопсии, составляло 6,6 мин (диапазон 2–32 мин). Округленное время отсечения 7 минут использовалось, чтобы показать, что «медленные» эндоскописты (время процедуры> 7 минут) с большей вероятностью выявляют поражения высокого риска (AG / GIM, дисплазия и рак) и неоплазию (рак или дисплазия). по сравнению с «быстрыми» эндоскопистами [отношение шансов (OR) 2,50; 95% доверительный интервал (ДИ): 1,52–4,12 и 3,42; 95% ДИ 1,25–10,38 соответственно]. 32
Наконец, недавнее ретроспективное исследование Park et al. проанализировали большой объем скрининговых EGD в Южной Корее, проведенных 14 сертифицированными эндоскопистами. 33 Точно так же эндоскописты были разделены на две группы в соответствии со временем осмотра (время выхода из D2 после очистки слизистой оболочки желудка). В многопараметрическом анализе использовалась отсечка в 3 минуты, чтобы показать, что «медленные» эндоскописты значительно чаще выявляли аденомы или рак желудка, чем «быстрые» эндоскописты (OR 1,52; 95% CI, 1,17–1,97). 33
После этих исследований ESGE рекомендует 7-минутное время процедуры (от интубации до экстубации) для первой диагностической эндоскопии UGI у каждого пациента, который не подвергался предыдущей EGD в течение последних 3 лет. 12
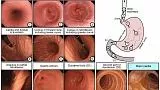
Фото-документация
Документация с изображениями стала неотъемлемой частью EGD-отчетности и контроля качества. Хотя нет данных, подтверждающих, что фотодокументация увеличивает диагностическую эффективность EGD, отчеты с достаточным количеством фотографий могут представлять собой юридическую запись полного обследования и предоставлять информацию о видимости слизистой оболочки и наличии любых потенциальных «слепых пятен». Желательно, чтобы все снимки делались после очистки слизистой оболочки, сохраняя центр просвета органа в центре изображения. Желудок должен быть достаточно инсуффлирован, чтобы участки слизистой оболочки между складками были хорошо видны.
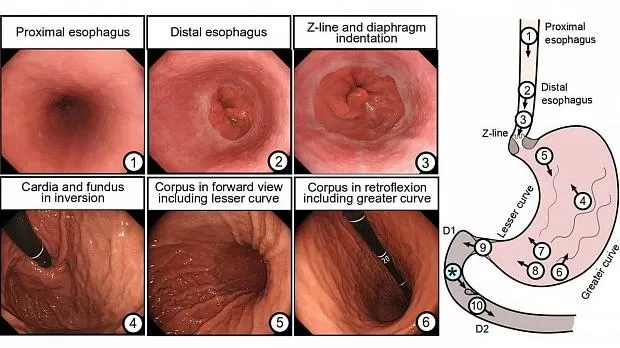
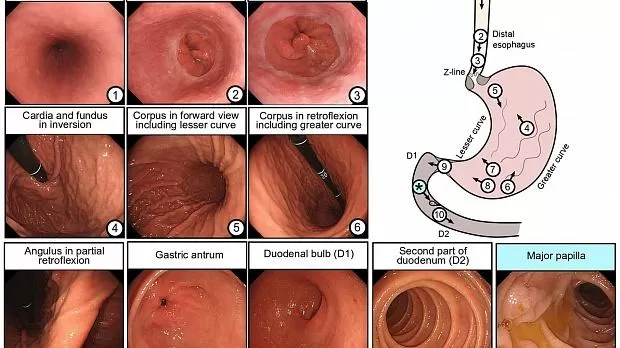
Минимальные требования к фотодокументации различны по всему миру и отражают различное бремя рака UGI в разных географических регионах. Например, в США, где заболеваемость раком желудка относительно низка, в рекомендациях по качеству не указано минимальное количество фотографий для отчетов EGD. 13 европейских требований, определенных ESGE, 12 аналогично BSG, 11Включите минимальное количество из 10 изображений для нормального эндоскопического исследования, которое должно включать: (1) проксимальный отдел пищевода, (2) дистальный отдел пищевода, (3) Z-линию и вдавливание диафрагмы, (4) кардия и глазное дно в инверсии, (5) корпус на виде вперед, включая меньшую кривизну, (6) корпус, в ретрофлексном виде, включая большую кривизну, (7) угол в частичной инверсии, (8) антральный отдел желудка, (9) луковица двенадцатиперстной кишки (D1) и (10) D2, как показано на рисунке 2. Следует отметить, что любые дополнительные отклонения от нормы следует документировать отдельно.
Рисунок 2. Фотодокументация.
D1 - луковица двенадцатиперстной кишки; D2, вторая часть двенадцатиперстной кишки.
Примечательно, что в Японии обычно делается 20–40 эндоскопических изображений во время скрининга EGD. Yao et al. предложила минимально необходимый стандарт, называемый «протоколом систематического скрининга желудка» (SSS), который включает 22 изображения для иллюстрации всего желудка. 35 Этот протокол редко соблюдается в западных странах.
Недавно возможность визуализировать главный сосочек двенадцатиперстной кишки была предложена в качестве индикатора качества, поскольку она отражает высокий профессионализм и внимание во время обследования. Корейское исследование 111 962 бессимптомных пациентов, перенесших ФГДС, показало, что частота фотодокументации ампулы достоверно коррелировала с обнаружением новообразований UGI [коэффициент детерминации ( R 2 ) = 0,57, p = 0,03). 36 Средний показатель фотодокументации ампулы составил 49,0% (диапазон 13,7 - 78,1%). ESGE предлагает визуализировать и сфотографировать главный сосочек двенадцатиперстной кишки во всех EGD (пациенты с нормальной анатомией, когда предполагается полное обследование). 12
Терминология и системы отчетности
Стандартизированная терминология - отличительная черта высококачественных отчетов по эндоскопии. 12 Системы классификации в эндоскопии в целом способствуют лучшему общению между клиницистами и исследователями и особенно важны в случаях международного сотрудничества. Использование стандартизированной терминологии указано ESGE в качестве ключевого показателя эффективности. 12
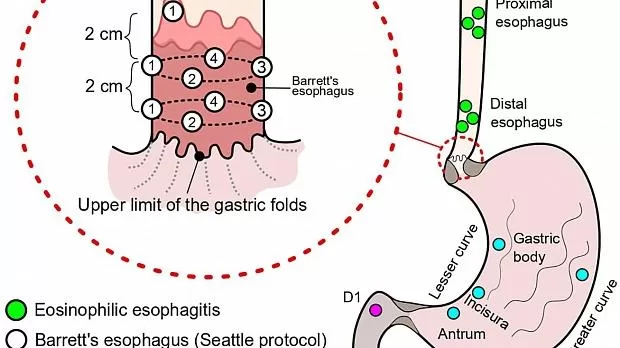
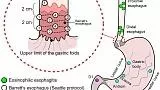
Более того, системы классификации могут определять дальнейшее управление. Например, Парижская классификация 37, используемая для характеристики морфологии поверхностных неопластических поражений в желудочно-кишечном тракте, может дать приблизительную оценку глубины инфильтрации (в слизистую оболочку или за ее пределами) и направить последующее лечение (эндоскопическая терапия в сравнении с хирургическим вмешательством). Система оценки эрозивного эзофагита Лос-Анджелеса (LA), 38с другой стороны, может сообщить о необходимости и сроках повторного обследования. А именно, пациенты с эзофагитом легкой и средней степени тяжести (степень LA A и B) не нуждаются в последующем обследовании; тем не менее, пациенты с тяжелым эзофагитом (степени от C до D по шкале LA) и, следовательно, с повышенным риском развития БЭ, должны пройти контрольную эндоскопию после 8 недель интенсивного антирефлюксного лечения. 39 Терминологический комитет Всемирной эндоскопической организации (WEO; ранее известный как OMED) регулярно публикует «минимальную стандартную терминологию для эндоскопии желудочно-кишечного тракта». 40 Список наиболее часто используемых систем эндоскопической классификации представлен в таблице 3 .
Table 3. Endoscopic classification systems.
|
Condition |
Classification |
|
General |
|
|
Neoplastic lesions |
Paris classification27 |
|
Esophagus |
|
|
Erosive esophagitis |
Los Angeles classification28 |
|
Barrett’s esophagus |
Prague classification41 |
|
Eosinophilic esophagitis |
EREFS classification42 |
|
Caustic esophagitis |
Zargar classification |
|
Candida esophagitis |
Kodsi classification43 |
|
Varices |
Baveno classification |
|
Stomach |
|
|
Bleeding ulcers |
Forrest classification44 |
|
Hiatus hernia |
Hill classification45 |
|
Duodenum |
|
|
Adenomas in patients with FAP |
Spigelman classification46 |
EREFS, endoscopic reference score; FAP, familial adenomatous polyposis
ESGE отдельно рассматривает требования к системам отчетности. 47 Согласно этим рекомендациям, высококачественные системы отчетов по эндоскопии должны быть электронными и интегрированы в системы историй болезни пациентов. Идентификаторы пациентов должны быть легко доступны для облегчения связи данных. Кроме того, отчеты должны быть основаны на вводе структурированных данных с использованием свободного ввода текста, ограниченного до минимума. Наконец, системы отчетов по эндоскопии должны включать данные и результаты гистопатологии, такие как удовлетворенность пациентов, нежелательные явления и рекомендации по наблюдению. 47
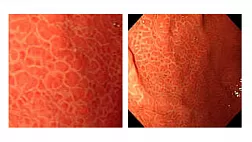
Продвинутые методы визуализации
Хотя EGD считается технически менее сложной процедурой, чем колоноскопия, спектр изменений слизистой оболочки, обнаруживаемых во время EGD, намного шире, поскольку он включает в себя оценку трех различных органов и эпителия в рамках одного исследования. В последние годы появились передовые методы визуализации, направленные на улучшение визуализации слизистой оболочки и улучшение тонкой структурной и микрососудистой архитектуры. 48
Текущий спектр установленных методов улучшения изображения (IE) включает обычную хромоэндоскопию, эндоскопию с узким спектром, такую как узкополосная визуализация (NBI; Olympus Medical Systems, Токио, Япония) и синяя лазерная визуализация (BLI; Fujifilm, Токио, Япония). ), но также и несколько других систем, таких как связанная цветная визуализация (LCI; Fujifilm, Токио, Япония), цифровой контраст i-Scan (I-SCAN; Pentax, Токио, Япония), автофлуоресцентная визуализация (AFI) и конфокальная лазерная эндомикроскопия. (CLE). Эти технологии находятся на другом уровне клинического применения и не будут подробно обсуждаться в этой статье?
Полный текст статьи:
Table 3. Endoscopic classification systems.
|
Condition |
Classification |
|
General | |
|
Neoplastic lesions | |
|
Esophagus | |
|
Erosive esophagitis | |
|
Barrett’s esophagus | |
|
Eosinophilic esophagitis | |
|
Caustic esophagitis | |
|
Candida esophagitis | |
|
Varices | |
|
Stomach | |
|
Bleeding ulcers | |
|
Hiatus hernia | |
|
Duodenum | |
|
Adenomas in patients with FAP |
EREFS - endoscopic reference score; FAP - familial adenomatous polyposis
 Раздел КЛАССИФИКАЦИИ
Раздел КЛАССИФИКАЦИИСписок литературы:
2. Shenbagaraj, L, Thomas-Gibson, S, Stebbing, J, et al. Endoscopy in 2017: a national survey of practice in the UK. Frontline Gastroenterol 2019; 10: 7–15.
3. Zhang, X, Li, M, Chen, S, et al. Endoscopic screening in Asian countries is associated with reduced gastric cancer mortality: a meta-analysis and systematic review. Gastroenterology 2018; 155: 347–354.e9.
Crossref
4. Coleman, HG, Xie, SH, Lagergren, J. The epidemiology of esophageal adenocarcinoma. Gastroenterology 2018; 154: 390–405.
5. Fitzgerald, RC, di Pietro, M, Ragunath, K, et al. British Society of Gastroenterology guidelines on the diagnosis and management of Barrett’s oesophagus. Gut 2014; 63: 7–42.
6. Shaheen, NJ, Falk, GW, Iyer, PG, et al.; American College of Gastroenterology . ACG clinical guideline: diagnosis and management of Barrett’s esophagus. Am J Gastroenterol 2016; 111: 30–50; quiz 51.
7. Weusten, B, Bisschops, R, Coron, E, et al. Endoscopic management of Barrett’s esophagus: European Society of Gastrointestinal Endoscopy (ESGE) position statement. Endoscopy 2017; 49: 191–198.
8. Bulois, P. Colonoscopic withdrawal times and adenoma detection during screening colonoscopy: commentary. Colon Rectum 2007; 1: 214–215.
Google Scholar
9. Kaminski, MF, Regula, J, Kraszewska, E, et al. Quality indicators for colonoscopy and the risk of interval cancer. N Engl J Med 2010; 362: 1795–1803.
10. Corley, DA, Jensen, CD, Marks, AR, et al. Adenoma detection rate and risk of colorectal cancer and death. N Engl J Med 2014; 370: 1298–1306.
11. Beg, S, Ragunath, K, Wyman, A, et al. Quality standards in upper gastrointestinal endoscopy: a position statement of the British Society of Gastroenterology (BSG) and Association of Upper Gastrointestinal Surgeons of Great Britain and Ireland (AUGIS). Gut 2017; 66: 1886–1899.
12. Bisschops, R, Areia, M, Coron, E, et al. Performance measures for upper gastrointestinal endoscopy: a European Society of Gastrointestinal Endoscopy (ESGE) quality improvement initiative. Endoscopy 2016; 48: 843–864.
13. Park, WG, Shaheen, NJ, Cohen, J, et al. Quality Indicators for EGD. Am J Gastroenterol 2015; 110: 60–71.
14. Chiu, PWY, Uedo, N, Singh, R, et al. An Asian consensus on standards of diagnostic upper endoscopy for neoplasia. Gut 2019; 68: 186–197.
15. Menon, S, Trudgill, N. How commonly is upper gastrointestinal cancer missed at endoscopy? A meta-analysis. Endosc Int Open 2014; 2: E46–E50.
16. Maltby, JR . Preoperative fasting guidelines. Can J Surg 2006; 49: 138–139.
17. Doyle, DJ, Garmon, EH. American Society of Anesthesiologists Classification (ASA Class). StatPearls Publishing; 2018.
Google Scholar
18. Matharoo, M, Thomas-Gibson, S, Haycock, A, et al. Implementation of an endoscopy safety checklist. Frontline Gastroenterol 2014; 5: 260–265.
19. Liu, X, Guan, CT, Xue, LY, et al. Effect of premedication on lesion detection rate and visualization of the mucosa during upper gastrointestinal endoscopy: a multicenter large sample randomized controlled double-blind study. Surg Endosc 2018; 32: 3548–3556.
20. Monrroy, H, Vargas, JI, Glasinovic, E, et al. Use of N-acetylcysteine plus simethicone to improve mucosal visibility during UGI endoscopy: a double-blind, randomized controlled trial. Gastrointest Endosc 2018; 87: 986–993.
21. Kim, GH, Cho, YK, Cha, JM, et al. Efforts to increase image quality during endoscopy: the role of pronase. World J Gastrointest Endosc 2016; 8: 267.
22. Early, DS, Ben-Menachem, T, Decker, GA, et al. Appropriate use of GI endoscopy. Gastrointest Endosc 2012; 75: 1127–1131.
23. Park, WG, Shaheen, NJ, Cohen, J, et al. Quality indicators for EGD. Gastrointest Endosc 2015; 81: 17–30.
24. Cass, OW, Freeman, ML, Peine, CJ, et al. Objective evaluation of endoscopy skills during training. Ann Intern Med 1993; 118: 40.
25. Ward, ST, Hancox, A, Mohammed, MA, et al. The learning curve to achieve satisfactory completion rates in UGI endoscopy: an analysis of a national training database. Gut 2017; 66: 1022–1030.
26. Siau, K, Green, JT, Hawkes, ND, et al. impact of the Joint advisory group on gastrointestinal endoscopy (Jag) on endoscopy services in the UK and beyond. Gastroenterology 2019; 10: 93–106.
Google Scholar
27. Conjoint committee for the recognition of training in gastrointestinal endoscopy . Information for Applicants|CCRTGE, http://www.conjoint.org.au/applicants.php (2015, accessed 13 July 2019).
Google Scholar
28. Ponich, T, Enns, R, Romagnuolo, J, et al. Canadian credentialing guidelines for esophagogastroduodenoscopy. Can J Gastroenterol 2008; 22: 349.
29. Eisen, GM, Baron, TH, Dominitz, JA, et al. Methods of granting hospital privileges to perform gastrointestinal endoscopy. Gastrointest Endosc 2002; 55: 780–783.
30. Moon, HS, Choi, EK, Seo, JH, et al. Education and Training Guidelines for the Board of the Korean Society of Gastrointestinal Endoscopy. Clin Endosc 2017; 50: 345–356.
31. Yao, K, Uedo, N, Muto, M, et al. Development of an e-learning system for the endoscopic diagnosis of early gastric cancer: an international multicenter randomized controlled trial. EBioMedicine 2016; 9: 140–147.
32. Teh, JL, Tan, JR, Lau, LJF, et al. Longer examination time improves detection of gastric cancer during diagnostic upper gastrointestinal endoscopy. Clin Gastroenterol Hepatol 2015; 13: 480–487.e2.
33. Park, JM, Huo, SM, Lee, HH, et al. Longer observation time increases proportion of neoplasms detected by esophagogastroduodenoscopy. Gastroenterology 2017; 153: 460–469.e1.
Crossref
34. Gupta, N, Gaddam, S, Wani, SB, et al. Longer inspection time is associated with increased detection of high-grade dysplasia and esophageal adenocarcinoma in Barrett’s esophagus. Gastrointest Endosc 2012; 76: 531–538.
35. Yao, K. The endoscopic diagnosis of early gastric cancer. Ann Gastroenterol 2013; 26: 11–22.
36. Park, JM, Lim, CH, Cho, YK, et al. The effect of photo-documentation of the ampulla on neoplasm detection rate during esophagogastroduodenoscopy. Endoscopy 2019; 51: 115–124.
37. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002 . Gastrointest Endosc 2003; 58(6 Suppl.): S3–43.
38. Armstrong, D, Bennett, JR, Blum, AL, et al. The endoscopic assessment of esophagitis: a progress report on observer agreement. Gastroenterology 1996; 111: 85–92.
39. Katz, PO, Gerson, LB, Vela, MF. Guidelines for the diagnosis and management of gastroesophageal reflux disease. Am J Gastroenterol 2013; 108: 308–328.
40. Aabakken, L, Rembacken, B, Lemoine, O, et al. Minimal standard terminology for gastrointestinal endoscopy MST 3.0. Endoscopy 2009; 41: 727–728.
41. Sharma, VK, Nguyen, CC, Crowell, MD, et al. A national study of cardiopulmonary unplanned events after GI endoscopy. Gastrointest Endosc 2007; 66: 27–34.
42. Levy, I, Gralnek, IM. Complications of diagnostic colonoscopy, upper endoscopy, and enteroscopy. Best Pract Res Clin Gastroenterol 2016; 30: 705–718.
43. Quine, MA, Bell, GD, McCloy, RF, et al. Prospective audit of perforation rates following upper gastrointestinal endoscopy in two regions of England. Br J Surg 1995; 82: 530–533.
44. Acosta, RD, Abraham, NS, Chandrasekhara, V, et al. The management of antithrombotic agents for patients undergoing GI endoscopy. Gastrointest Endosc 2016; 83: 3–16.
45. Loftus, R, Nugent, Z, Graff, LA, et al. Patient satisfaction with the endoscopy experience and willingness to return in a central Canadian health region. Can J Gastroenterol 2013; 27: 259–266.
46. Ekkelenkamp, VE, Dowler, K, Valori, RM, et al. Patient comfort and quality in colonoscopy. World J Gastroenterol 2013; 19: 2355–2361.
47. Bretthauer, M, Aabakken, L, Dekker, E, et al. Reporting systems in gastrointestinal endoscopy: requirements and standards facilitating quality improvement: European Society of Gastrointestinal Endoscopy position statement. United European Gastroenterol J 2016; 4: 172–176.
SAGE Journals |
48. East, JE, Vleugels, JL, Roelandt, P, et al. Advanced endoscopic imaging: European Society of Gastrointestinal Endoscopy (ESGE) technology review. Endoscopy 2016; 48: 1029–1045.
49. Dubuc, J, Legoux, J-L, Winnock, M, et al. Endoscopic screening for esophageal squamous-cell carcinoma in high-risk patients: a prospective study conducted in 62 French endoscopy centers. Endoscopy 2006; 38: 690–695.
50. Hashimoto, CL, Iriya, K, Baba, ER, et al. Lugol’s dye spray chromoendoscopy establishes early diagnosis of esophageal cancer in patients with primary head and neck cancer. Am J Gastroenterol 2005; 100: 275–282.
51. Chai, T-H, Jin, X-F, Li, S-H, et al. A tandem trial of HD-NBI versus HD-WL to compare neoplasia miss rates in esophageal squamous cell carcinoma. Hepatogastroenterology 2014; 61: 120–124.
52. Inoue, H, Kaga, M, Ikeda, H, et al. Magnification endoscopy in esophageal squamous cell carcinoma: a review of the intrapapillary capillary loop classification. Ann Gastroenterol 2015; 28: 41–48.
53. Sharma, P, Katzka, DA, Gupta, N, et al. Quality indicators for the management of Barrett’s esophagus, dysplasia, and esophageal adenocarcinoma: international consensus recommendations from the american gastroenterological association symposium. Gastroenterology 2015; 149: 1599–1606.
54. Tholoor, S, Bhattacharyya, R, Tsagkournis, O, et al. Acetic acid chromoendoscopy in Barrett’s esophagus surveillance is superior to the standardized random biopsy protocol: results from a large cohort study (with video). Gastrointest Endosc 2014; 80: 417–424.
55. Levine, DS, Haggitt, RC, Blount, PL, et al. An endoscopic biopsy protocol can differentiate high-grade dysplasia from early adenocarcinoma in Barrett’s esophagus. Gastroenterology 1993; 105: 40–50.
56. Chedgy, F, Fogg, C, Kandiah, K, et al. Acetic acid-guided biopsies in Barrett’s surveillance for neoplasia detection versus non-targeted biopsies (Seattle protocol): a feasibility study for a randomized tandem endoscopy trial. The ABBA study. Endosc Int Open 2018; 6: E43–E50.
57. Sharma, P, Bergman, JJGHM, Goda, K, et al. Development and validation of a classification system to identify high-grade dysplasia and esophageal adenocarcinoma in Barrett’s esophagus using narrow-band imaging. Gastroenterology 2016; 150: 591–598.
58. Pimentel-Nunes, P, Libânio, D, Marcos-Pinto, R, et al. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Port. Endoscopy 2019; 51: 365–388.
59. Fujiyoshi, T, Miyahara, R, Funasaka, K, et al. Utility of linked color imaging for endoscopic diagnosis of early gastric cancer. World J Gastroenterol 2019; 25: 1248–1258.
60. Dohi, O, Yagi, N, Onozawa, Y, et al. Linked color imaging improves endoscopic diagnosis of active Helicobacter pylori infection. Endosc Int Open 2016; 4: E800–E805.
61. Mori, Y, Kudo, S-E, Mohmed, HEN, et al. Artificial intelligence and upper gastrointestinal endoscopy: current status and future perspective. Dig Endosc 2019; 31: 378–388.
62. Cai, SL, Li, B, Tan, WM, et al. Using a deep learning system in endoscopy for screening of early esophageal squamous cell carcinoma (with video). Gastrointest Endosc 2019; 90: 745–753.e2.
Crossref
63. Groof, J de, van der Sommen, F, van der Putten, J, et al. The Argos project: The development of a computer-aided detection system to improve detection of Barrett’s neoplasia on white light endoscopy. United Eur Gastroenterol J 2019; 7: 538–547.
SAGE Journals |
64. Januszewicz, W, Wieszczy, P, Bialek, A, et al. Endoscopist biopsy rate as a quality indicator for outpatient gastroscopy: a multicenter cohort study with validation. Gastrointest Endosc 2019; 89: 1141–1149.
65. Lucendo, AJ, Molina-Infante, J, Arias, Á, et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United Eur Gastroenterol J 2017; 5: 335–358.
SAGE Journals |
66. Correa, P, Haenszel, W, Cuello, C, et al. A model for gastric cancer epidemiology. Lancet 1975; 306: 58–60.
Crossref
67. Dixon, MF, Genta, RM, Yardley, JH, et al. Classification and grading of Gastritis: the updated Sydney system. Am J Surg Pathol 1996; 20: 1161–1181.
68. Yue, H, Shan, L, Bin, L. The significance of OLGA and OLGIM staging systems in the risk assessment of gastric cancer: a systematic review and meta-analysis. Gastric Cancer 2018; 21: 579–587.
69. Isajevs, S, Liepniece-Karele, I, Janciauskas, D, et al. The effect of incisura angularis biopsy sampling on the assessment of gastritis stage. Eur J Gastroenterol Hepatol 2014; 26: 510–513.
70. Kim, Y-I, Kook, M-C, Cho, S-J, et al. Effect of biopsy site on detection of gastric cancer high-risk groups by OLGA and OLGIM stages. Helicobacter 2017; 22: e12442.
Crossref
71. van der Post, RS, Vogelaar, IP, Carneiro, F, et al. Hereditary diffuse gastric cancer: updated clinical guidelines with an emphasis on germline CDH1 mutation carriers. J Med Genet 2015; 52: 361–374.
72. Husby, S, Murray, JA, Katzka, DA. AGA clinical practice update on diagnosis and monitoring of celiac disease—changing utility of serology and histologic measures: expert review. Gastroenterology 2019; 156: 885–889.
73. Ludvigsson, JF, Bai, JC, Biagi, F, et al. Diagnosis and management of adult coeliac disease: guidelines from the British society of gastroenterology. Gut 2014; 63: 1210–1228.
74. McQuaid, KR, Laine, L. A systematic review and meta-analysis of randomized, controlled trials of moderate sedation for routine endoscopic procedures. Gastrointest Endosc 2008; 67: 910–923.
75. Early, DS, Lightdale, JR, Vargo, JJ, et al. Guidelines for sedation and anesthesia in GI endoscopy. Gastrointest Endosc 2018; 87: 327–337.
76. Hedenbro, JL, Lindblom, A. Patient attitudes to sedation for diagnostic upper endoscopy. Scand J Gastroenterol 1991; 26: 1115–1120.
77. Quine, MA, Bell, GD, McCloy, RF, et al. Prospective audit of upper gastrointestinal endoscopy in two regions of England: safety, staffing, and sedation methods. Gut 1995; 36: 462–467.
78. Silvis, SE, Nebel, O, Rogers, G, et al. Endoscopic complications: results of the 1974 American Society for Gastrointestinal Endoscopy Survey. JAMA J Am Med Assoc 1976; 235: 928–930.
79. Daneshmend, TK, Bell, GD, Logan, RFA. Sedation for upper gastrointestinal endoscopy: results of a nationwide survey. Gut 1991; 32: 12–15.
80. Sieg, A, Hachmoeller-Eisenbach, U, Eisenbach, T. Prospective evaluation of complications in outpatient GI endoscopy: a survey among German gastroenterologists. Gastrointest Endosc 2001; 53: 620–627.
81. Brown, S, Bevan, R, Rubin, G, et al. Patient-derived measures of GI endoscopy: a meta-narrative review of the literature. Gastrointest Endosc 2015; 81: 1130–1140.e9.
Crossref
82. Yacavone, RF, Richard Locke, G, Gostout, CJ, et al. Factors influencing patient satisfaction with GI endoscopy. Gastrointest Endosc 2001; 53: 703–710.
83. Hutchings, HA, Cheung, WY, Alrubaiy, L, et al. Development and validation of the Gastrointestinal Endoscopy Satisfaction Questionnaire (GESQ). Endoscopy 2015; 47: 1137–1143.
84. Wang, MC, Zhang, LY, Zhang, YL, et al. Effect of music in endoscopy procedures: systematic review and meta-analysis of randomized controlled trials. Pain Med (United States) 2014; 15: 1786–1794.
85. van Zuuren, FJ, Grypdonck, M, Crevits, E, et al. The effect of an information brochure on patients undergoing gastrointestinal endoscopy: a randomized controlled study. Patient Educ Couns 2006; 64: 173–182.
86. Raftopoulos, SC, Segarajasingam, DS, Burke, V, et al. A cohort study of missed and new cancers after esophagogastroduodenoscopy. Am J Gastroenterol 2010; 105: 1292–1297.
87. Hosokawa, O, Hattori, M, Douden, K, et al. Difference in accuracy between gastroscopy and colonoscopy for detection of cancer. Hepatogastroenterology 2007; 54: 442–444.
88. Westerveld, D, Khullar, V, Mramba, L, et al. Adherence to quality indicators and surveillance guidelines in the management of Barrett’s esophagus: a retrospective analysis. Endosc Int Open 2018; 6: E300–E307.
Статьи по теме
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.














.jpg)




.png)


 (1).jpg)














Комментарии